实验室配制500mL0.1mol/L Na2CO3溶液回答下列问题
(1)需Na2CO3·10H2O晶体____ ___g
(2)现有以下仪器:①烧杯 ②250ml容量瓶 ③500ml容量瓶 ④量筒 ⑤玻璃棒 ⑥胶头滴管 ⑦托盘天平,配制Na2CO3溶液时需用的主要仪器有_________ ___。
(3)若实验遇下列情况,配得溶液的浓度是偏高,偏低还是无影响?
A. 容量瓶内壁附有水珠而未干燥处理____________ 。
B. 溶解后没有冷却便进行定容______________ 。
C. 定容观察刻度时俯视_____________。
某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。
(1)在混合物A中先加过量的BaCl2溶液除去的离子是;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是。
(2)在溶液C中加入的足量试剂X是 。
(3)操作②的分离方法分别是。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为。
已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下装置(填序号)。简述该装置能随关随停的理由。
(2)为使实验能够进行,在B方框内内应选用上图中的装置(填写序号),该装置内应装入的试剂是。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为(产率为实际产量占理论产量的百分比)。
下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。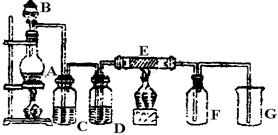
试回答:
(1)A中发生的化学反应方程式为。
(2)C、D、G中各装的药品:C__________;D__________;G__________。
(3)E中的现象为;反应方程式为。
(4)写出G中反应的离子方程式。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因。
(17分)某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
已知:①FeO + 2H+= Fe2+ + H2O②Fe2O3 + 6H+ = 2Fe3+ +3 H2O ③Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4 H2O
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为。
(2)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意),若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)。
| A.一定有Fe3O4,可能有Fe | B.只有Fe(OH)3 | C.一定有Fe3O4和Fe |
| D.一定有Fe(OH)3,可能有Fe E.只有Fe3O4 |
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式。
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是,并且配制含Fe2+的盐溶液时应加入少量。
(6)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是______________。反应开始时,打开止水夹的目的是___________________________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2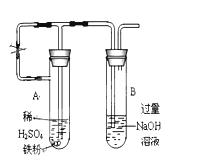
某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一]取样品0.100 g,用右图所示实验装置进行测定。(夹持装置省略)
(1)检查装置A气密性的方法是 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准状况),则样品中Na2O2的纯度为 。
[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250 mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 标准盐酸体积(mL) |
23.00 |
24.98 |
25.00 |
25.02 |
由表中数据可知,标准盐酸体积的平均值为 mL。若滴定前用上述所配溶液润洗锥形瓶,对测定盐酸体积产生的影响是 (填“偏高”、“偏低”或“无影响”)。
[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小。经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因。查阅资料发现:
Na2O2与水反应产生的H2O2未完全分解。
①写出Na2O2与水生成H2O2的化学方程式 。
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案: 。