(每空1分,共8分)利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极( 、 )、稀硫酸、 (填写所缺的实验用品)、耳机(或者电流计)。
(3)实验装置:
(4)原电池设计及注意的问题。

①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为 。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的 极,电极反应是 ;另一极应该接电流计的 极,电极发生了 反应(“氧化”或“还原”)。
纯碱在日常生活和工业生产中用途广泛,需求量很大,因此纯碱的制备一直是科学家工作的一个重要方面。19世纪欧洲有个吕布兰制碱法,其主要反应原理是:
Na2SO4+2C Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3====CaS+Na2CO3
这种方法的最大缺点是:①此反应是高温固体反应,不能连续生产;②浪费原料,CO2不能回收利用;③污染环境,CaS没有任何用处,只能抛至野外。由于这些缺点的存在和后来化学工业的发展,吕布兰法被索尔维法代替。索尔维法的生产流程如下:
索尔维法能实现连续生产,但其食盐利用率只有75%,且所得副产品CaCl2没有用处,污染环境。
我国化学家侯德榜经过一年的努力,做了500多次循环实验,终于设计出新的制碱工艺,于1943年11月在完成实验室规模的流程实验基础上,在工厂顺利试产,食盐的利用率达96%以上,得到了纯碱和氯化铵两种重要产品。氯化铵主要用作氮肥。侯德榜制碱法原理是:
①在30~50 ℃的饱和食盐水中,先通入氨至饱和,再通入二氧化碳得到碳酸氢钠沉淀;
②过滤,将滤渣加热而得到产品;
③滤液中加入细食盐末,在10~15 ℃,使NH4Cl沉淀,滤液为饱和食盐水。
据此回答下列问题:
(1)标出反应Na2SO4+2C Na2S+2CO2↑的电子转移方向和数目。
Na2S+2CO2↑的电子转移方向和数目。
(2)写出索尔维制碱法的各步反应的化学反应方程式:
①_________________________
②_________________________
③_________________________
④_________________________
(3)写出侯德榜制碱法第①步反应的化学方程式_________________________
(4)在索尔维制碱法中____________物质可循环利用。
(5)在侯德榜制碱法中____________物质可循环利用。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。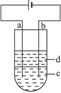
(1)a电极材料应为________________________________________,电极反应式为
_______________________________________________________;
(2)电解液c可以是(填编号)()
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为______________________________________________________,在加入苯之前对c应作怎样的简单处理?
______________________________________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)()
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间距离
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为________________________________。
测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨②称量空坩埚和装有试样的坩埚的质量③加热④冷却⑤称量⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1 g为止⑦根据实验数据计算硫酸铜晶体里结晶水的含量。
请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是
____________________________________________。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?答:
____________________________________________。
(3)实验步骤⑥的目的是________________________________________________________。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号):_______________________。
| A.被测样品中含有加热不挥发的杂质 | B.被测样品中含有加热易挥发的杂质 |
| C.实验前被测样品已有部分失水 | D.加热前所用的坩埚未完全干燥 |
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是________________________________________。
(2)装置E中的现象是______________________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:___________________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
①步骤Ⅰ中通入Cl2的作用是___________________________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:_________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)_______________。
三瓶中分别盛有蒸馏水、暂时硬水、永久硬水,请自选试剂设计一个简单的实验,将其区别开来。