目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
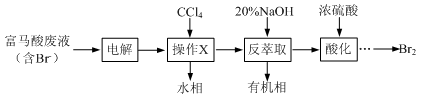
(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
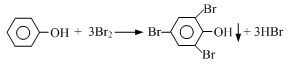
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(用化学方程式表示)。
(3)以下收集NO气体的装置,合理的是________(填选项代号)。
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
甲:铜 硝酸铜
硝酸铜
乙:铜 硝酸铜
硝酸铜
丙:铜 氯化铜
氯化铜 硝酸铜
硝酸铜
丁:铜 氧化铜
氧化铜 硝酸铜。
硝酸铜。
(1)探究一溴环己烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙两位同学分别设计如下两个实验方案:
甲:向反应混合物中滴入稀HNO3中和NaOH,后滴入AgNO3溶液,若有浅黄色沉淀,则可以证明发生了消去反应。
乙:向反应混合物中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。请评价上述两个方案是否合理,并说明理由。
甲:_________,______________________________________________________。
乙:_________,______________________________________________________。
(2)如图所示为实验室制取少量硝基苯的装置.根据题意完成下列填空:
①写出制取硝基苯的化学方程式_______________________。
②长玻璃导管的作用是_______________________。
③硝基苯有毒,如果少量的液体溅在皮肤上,应用擦洗.
| A.苯 | B.酒精 | C.硫酸 | D.水. |
(3)某实验小组用下列装置进行乙醇催化氧化的实验.
甲和乙两个水浴作用不相同.甲的作用是;
乙的作用是______________。
(1)实验室从海带中提取碘的流程如下:
①在进行实验b的过程中,可以选择的有机溶剂是__________。
A.酒精B.四氯化碳 C.苯
②从I2的有机溶液中提取碘的装置如图1所示,请指出仪器d的名称____。冷凝管中的水流方向是(填“由e至f”或“由f至e”)
(2)图2是实验室制取乙酸乙酯的实验装置,回答下列问题:
①在A试管中加入试剂的顺序是。
A.先浓硫酸再乙醇后乙酸
B.先浓硫酸再乙酸后乙醇
C.先乙醇再浓硫酸后乙酸
②在试管B中常加入________(填写试剂)来接收乙酸乙酯,分离出乙酸乙酯的主要仪器是。
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
| 密度g/mL |
熔点/℃ |
沸点/℃ |
水溶性 |
|
| 乙醇 |
0.79 |
-114 |
78 |
溶 |
| 乙酸 |
1.049 |
16.2 |
117 |
溶 |
| 乙酸乙酯 |
0.902 |
−84 |
76.5 |
不溶 |
合成反应:在三颈烧瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片。漏斗加入乙酸14.3 mL,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)制取乙酸乙酯化学方程式为:____________________。
(2)浓硫酸与乙醇如何混合?。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_______(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?。
(5)蒸出的粗乙酸乙酯中主要有哪些杂质?。
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示);。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?。
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在中加热(填仪器编号)。
①烧杯 ②瓷坩埚③蒸发皿④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。
①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞,打开旋塞,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②检验K2MnO4歧化完全的实验操作是。
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至,自然冷却结晶,抽滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为(保留4位有效数字,已知M(KMnO4)=158g·mol-1)。若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将。(填“偏大”、“偏小”、“不变”)