为证明草木灰的主要成分是K2CO3,设计如下实验:
(1)提取碳酸钾晶体,可供选择的实验操作步骤有:
A过滤B溶解C浓缩结晶D蒸发E冷却结晶F萃取G蒸馏.按照操作顺序,应选择有__________(写编号)在实验中都要用到的仪器是____________.
(2)鉴定提取的晶体是碳酸钾________________________.
工业纯碱中常常含有NaCl、Na2SO4等杂质。为测定某工业纯碱的纯度,设计了如下图实验装置。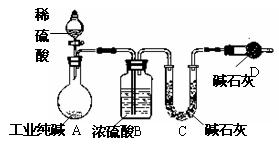
依据实验设计,请回答:
(1)装置中盛装稀硫酸的仪器名称是;
装置D的作用是
。
(2)为达到测定某工业纯碱的纯度实验目的,一次实验中至少应进行称量操作的次数为。
(3)若不考虑操作、药品及其用量等方面
的影响,该实验测得结果会 (填“偏高”、“偏低”、“无影响”);
原因是
(你若认为无影响,该空不用回答)。
已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
| A.砝码生锈 | B.定容时俯视 |
| C.称量时物质和砝码位置反了(需要游码) | D.容量瓶用待装液润 |
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
(10分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀 H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点?
。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”),原因是。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol·L-1 (计算出结果到小数点后二位)
下列有关实验操作或结果的说法中正确的是(在给出的选项中,至少有两项是符合题目要求的)
| A.将pH试纸用蒸馏水湿润后,测量某溶液的pH |
| B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验 |
| D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样 |
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
海水中含有丰富的化学元素,如图是某化工厂利用海水的生产镁的流程简图,请回答:
(1)实验室中蒸发浓缩液体需要的仪器有玻璃棒、酒精灯、三角架和 。
(2)反应③需加入的试剂为 。
(3)反应④中电能转化为 。
(4)反应②完成后,需进行的操作是 。
(5)B物质中含有化学键为 。