下列有关实验操作或结果的说法中正确的是 (在给出的选项中,至少有两项是符合题目要求的)
| A.将pH试纸用蒸馏水湿润后,测量某溶液的pH |
| B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验 |
| D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样 |
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4·FeSO4·6H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O↓
如图为制取摩尔盐的简要流程:
请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是。
(2)步骤②中的操作是加热蒸发、、。为什么不能加热蒸干?。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的试纸、稀盐酸和溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和,预期的现象和结论是。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4. 0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL
①本实验的指示剂是(填字母)。
| A.酚酞 | B.石蕊 | C.甲基橙 | D.不需要 |
②KMnO4溶液置于_(填“酸式”或“碱式”)滴定管中·
③滴定终点的现象是___。
④产品中Fe2+的百分含量是___。
硫代硫酸钠(Na2S2O3)可由下面一系列反应制得:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3 + S  Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;
Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。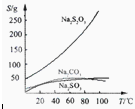
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。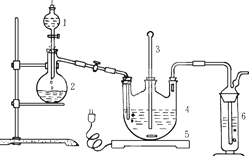
请问:仪器2的名称为,
装置6中可放入。
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:
(1)为减少产品的损失,操作①为,操作②是、洗涤、干燥,其中洗涤操作是用(填试剂)作洗涤剂。
(2)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应: 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为,
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为mol/L。
【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
(1)上述生产流程的第一步是“浸泡”,它的实验目的是;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂;
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是()() (按操作的先后顺序填写);


 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化。工业通常不用氯气氧化原因是(用离子方程式表示)
;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是(填写“游离态”或“化合态”)。解吸后应加入(填写下列编号:A.氧化剂、B.还原剂)可以实现碘析。
为探究Cl2、漂白粉的制备及有关性质,某兴趣小组设计并进行了以下实验探究。请回答以下问题:
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→_______、_______→_______、_______→_______;其中广口瓶Ⅱ中的试剂为_______。

(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式_______;
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2。请设计实验,探究该样品中除CaCl2外还含有的其他固体物质。
①提出合理假设。
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有______;
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3。
②设计实验方案,进行实验。请在下表中写出实验步骤、预期现象和结论。
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1 mol·L-1 HCl溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-。)
| 实验步骤 |
预期现象与结论 |
|
| 步骤1 |
取少量上述漂白粉于试管中,先加入溶解后,再把生成的气体通入。 |
若,则假设1成立; 若,则假设2或假设3成立。 |
| 步骤2 |
已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1 mol·L-1 HCl溶液,再加入。 |
若,则假设2成立; 若,则假设3成立。 |
硫酸钠-过氧化氢-氯化钠加合物(xNaSO4·yH2O2·zNaCl)又称固体双氧水,是一种新型精细化工产品,具有漂白、杀菌、消毒等作用。为探究该加合物的组成,某化学兴趣小组设计并进行了如下实验:
第一步:准确称取6.945g样品,配制成250.00ml无色溶液A
第二步:准确量取25.00ml溶液A于锥形瓶中,加适量稀硫酸酸化后,用0.0400mol/LKMnO4标准溶液滴定至终点,消耗溶液KMnO420.00ml
第三步:另取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.932g.
请回答下列问题:
(1)欲配制无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有。
(2)配平下列离子方程式______MnO4-+_____H2O2+_________=______Mn2++_____O2↑+______。
(3)滴定前,KMnO4标准溶液应盛装于中(填仪器名称),滴定终点现象为。
(4)第三步能否通过加入AgNO3溶液的方法来测定?为什么
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则Y值______________(填“偏
高 偏低 无影响”)
(6)通过计算确定样品的组成为。