【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
(1)上述生产流程的第一步是“浸泡”,它的实验目的是 ;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂 ;
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是( )( ) (按操作的先后顺序填写);


 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化。工业通常不用氯气氧化原因是(用离子方程式表示)
;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是 (填写“游离态”或“化合态”)。解吸后应加入 (填写下列编号:A.氧化剂、B.还原剂)可以实现碘析。
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。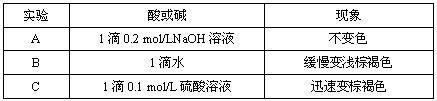
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是(填序号)。
a.长颈漏斗 b.圆底烧瓶 c.温度计 d.酒精灯 e.洗气瓶 f.烧杯
无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用下图所示装置来确定该化学反应中各物质的计量关系
试回答:


⑴加热过程中,试管A中发生的实验现象为。
⑵装置E和F的作用是;
⑶该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确
吗?为什么?
⑷该学生利用上述装置将一定质量的无水硫酸铜置于A中加热使其分解,最后测得氧
气的体积偏小,其原因可能是 (填序号)
| A.无水硫酸铜未完全分解 |
| B.实验结束时装置A中残留有气体 |
C.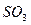 被 被 溶液吸收时产生了 溶液吸收时产生了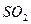 气体 气体 |
| D.最后读量筒中的读数时,E中的液面低于F中的液面 |
⑸另一学生将4.8g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为mol,三氧化硫为mol。
⑹由上述实验数据可知无水硫酸铜受热分解的化学方程式为:


___________________________________________________________________
某学生做浓硫酸性质的实验: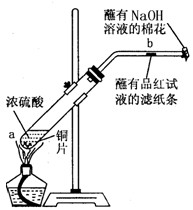
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象
回答下列问题:
(1)写出试管中发生反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)蘸有NaOH溶液的棉花团作用是。
(4)硫酸型酸雨的形成过程可用下列反应中的来表示。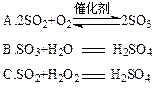
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:
(1)写出试管a中发生的化学方程式:。
(2) 试管b中所盛的溶液为,
试管b中所盛的溶液为,
其主要作用是___________________________。
(3)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是_____________________ 。
(4)该实验中,若用3mol乙醇和1mol乙酸
在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯?(填“能”或“不能”),原因是(不考虑原料损耗)。
⑴写出下图石油的蒸馏装置中所指仪器的名称:
a.____________ b._________
⑵指出右图石油的蒸馏装置中的错误之处:
①缺铁圈和
②缺(防液体暴沸)
③
④