硫代硫酸钠(Na2S2O3)可由下面一系列反应制得:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3 + S  Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;
Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。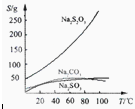
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。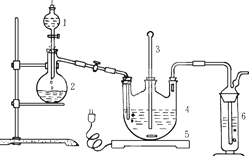
请问:仪器2的名称为 ,
装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:
(1)为减少产品的损失,操作①为 ,操作②是 、洗涤、干燥,其中洗涤操作是用 (填试剂)作洗涤剂。
(2)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应: 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为 mol/L。
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1.4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
⑴步骤Ⅰ的目的是除不溶性杂质。所需操作的名称是________、________。
⑵步骤Ⅱ的目的是除硫酸亚铁。操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①写出用H2O2溶液除去硫酸亚铁的离子方程式____________________________。
②调整pH 的范围应该在____________之间。
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是将溶液加热蒸发至有晶膜出现时,停止加热,_____________,水浴加热烘干。采用水浴加热的原因是____。
⑷该同学用CuSO4溶液进行如下探究实验:取A、B两支试管,分别加入 2 mL 5%H2O2溶液,再向H2O2溶液中分别滴入0.1 mol·L-1FeCl3和CuSO4溶液各1 mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确________(填正确或错误),请说明原因。
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为 ,饱和亚硫酸中
,饱和亚硫酸中 。
。
(1) 将0.1 mol • L—1的BaCl2溶液滴入饱和亚硫酸中,_______ (填“能”或“不能”)生成BaSO3沉淀,原因是______________ (请写出必要的推断过程)。
(2) 浓硫酸的沸点为338°C,酒精灯火焰的温度为400〜5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
(3) 乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。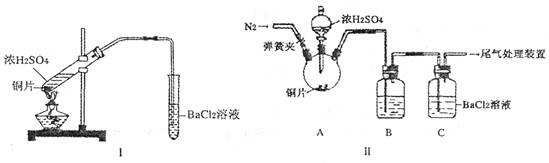
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4) 丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
| A.NaOH溶液 | B.Na[Al(OH)4]溶液 | C.H2O2溶液 | D.酸性 KMnO4溶液 |
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
(1)为了探究干燥的SO2能不能使品红褪色,某同学设
计了如右图所示实验装置,请指出实验装置图设计中的
不合理之处。
①;
②。
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO—3和SO32-,不是H2SO3。你认为他的结论是否正确____,其理由是。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml。于两只小烧杯中,两只烧杯中同时一次性各加入20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加人亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“____”内容。
②根据实验和分析,该同学得出的结论是.
下图是某同学设计的木炭和浓硫酸反应并检验所得产物的实验装置。请回答:
⑴在装置①-④中,有明显错误的一个是(填编号)
⑵写出木炭和浓硫酸反应的化学方程式:。
如果有0.4mol电子转移,则在标准状况下产生气体L。
⑶无水硫酸铜的作用是
⑷装置①中所盛试剂是(填字母),装置④中所盛试剂是(填字母)。
A. 品红溶液 B. 澄清的石灰水 C. 酸性高锰酸钾溶液
(6分)下图表示配制100 mL 0.10 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: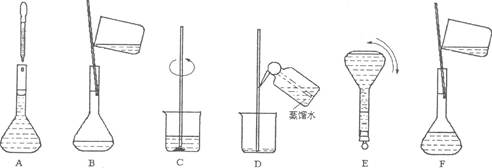
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是。
(2)步骤B通常称为转移,步骤A通常称为。
(3)将上述实验步骤A—F按实验过程先后次序排列。