【改编】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的流程如下:

(1)黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中x、y、z的代数关系式为 。
(2)检验滤液中是否存在NH4+的操作是 。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾中n(OH-): n(NH4+)(写出计算过程) 。
Ⅰ 以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。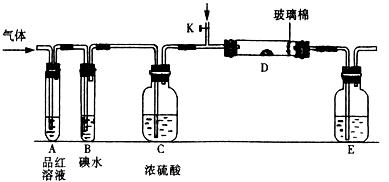
①若从左端分别通 入SO2和Cl2,装置A中观察到的现象是否相同?(填“相同”或“不相同”);若装置D中装的
入SO2和Cl2,装置A中观察到的现象是否相同?(填“相同”或“不相同”);若装置D中装的 是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为。
是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母),仍然无法观察到沉淀产生。
A.氨水 B.稀盐 酸 C.硝酸钾溶
酸 C.硝酸钾溶 液 D.硫化钠溶液
液 D.硫化钠溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出C l2与含X的溶液反应的离子方程式。
l2与含X的溶液反应的离子方程式。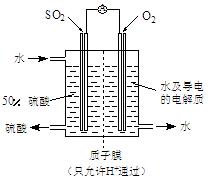
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如上图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_________极,其电极反应式为;电池的总反应式
Ⅱ 实验是化学研究的基础,关于下列各装置图的叙述正确的是(填序号)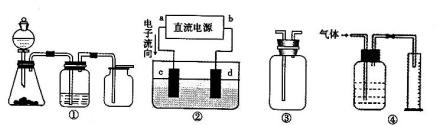
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中 ,a为正扳,d为阳极
,a为正扳,d为阳极
C.装置③可用于收集H 2、NH3、Cl2,、HCl、NO2等
2、NH3、Cl2,、HCl、NO2等
D .装置④能用于测量气体体积
.装置④能用于测量气体体积
Ⅲ用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是(填序号)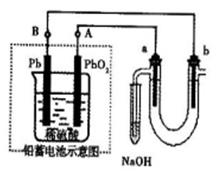
A.铅蓄电池负极的反应式为:Pb—2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。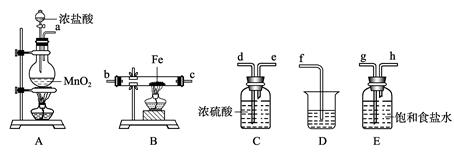
请回答下列问题:
(1) A中发生反应的化学方程式为______ _________________________________。
_________________________________。
(2)各装置的正确连接顺序为(填写装置代号)A→______→______→______→
______D。
(3)装置C的作用是________________________________________________,
写出装置D中反应的离子方程式___________ _________________________。
_________________________。
(4)反应开始后,B中硬质玻璃管内的现象为______________________________ ;
;
可以检验生成物中含有Fe3+的试剂是____________(填写试剂名称)。
(5) 该小组欲用下图所示装置收集尾气,并测量多余气体的体积。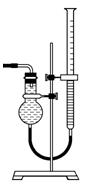
①若如 图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,上图装置中的液体可用________,
收集完气体后,读数前应进行的操作是____________。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面, 会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
(1)化学是一门以实验为基础的学科,下列实验操作的描述中,正确的是_______________(填序号)。
①为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
②用托盘天平称取10.4 g食盐时,将食盐放在右盘中的纸片上称量
③配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
(2)下列说法中,符合安全要求的是__________(填序号)。
①在通风橱内做铜与浓硝酸反应的实验
②实验中剩余的过氧化钠粉末用纸包裹好后,放入垃圾桶内
③闻氯气的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔
④为了节约时间,锌与稀硫酸反应一开始有氢气放出,就直接做氢气点燃实验
为测定粗氧化铜(其中含少量氧化亚铁及不溶于酸的杂质)中CuO的质量分数,并 制取无水硫酸铜,某化学活动小组进行了下列实验:
制取无水硫酸铜,某化学活动小组进行了下列实验:
已知Fe3+、Cu2+、Fe2+三种离子在溶液中形成氢氧化物沉淀的pH范围如下:
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是(填字母),装置d中仪器A和B的名称分别为。
(2)溶液A中所含溶质的化学式为。
(3)步骤②发生反应的离子方程式为。
(4)沉淀II的化学式为。
(5)粗氧化铜样品中CuO的质量分数为。(列出计算式)
兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd。请回答下列问题:
(1)上图装置2中应盛放溶液(写化学式)。
(2)为了使反应随开随用,随关随停,上图方框内应选用装置(填上图字母代号)。
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行1装置的操作,待装置(填数字编号)中出现现象时,再点酒精 灯,这步操作的目的是
(4)①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为。
(5)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有Na2O和C: