兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色的Pd。请回答下列问题:
(1)上图装置2中应盛放 溶液(写化学式)。
(2)为了使反应随开随用,随关随停,上图方框内应选用 装置(填上图字母代号)。
(3)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行1装置的操作,待装置 (填数字编号)中出现 现象时,再点酒精 灯,这步操作的目的是
(4)①若装置6中有黑色沉淀生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为 。
(5)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳。当确认钠充分反应后,请你设计一个简单实验,验证装置4中的残留固体中是否有Na2O和C:
某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水蒸气反应”的实验。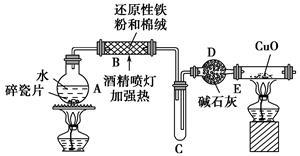
(1)硬质玻璃管B中发生反应的化学方程式为____________________。
(2)反应前A中投放碎瓷片的目的是______________________。
(3)装置E中的现象是___________________________。
探究二 设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于________后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);若溶液未变红色,推断硬质玻璃管B中固体物质的成分为________。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
|

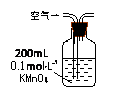
Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
| 序号 |
A |
B |
C |
| 装置 |
 |
 |
 |
| 原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。
(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、Fe(NO3)3溶液
| 实验步骤 |
预期现象和结论 |
关于电解池应用的规律提炼题组
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
(1)通O2的Pt电极为电池 极(填电极名称),其电极反应式为 。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为 ,电解质溶液为 。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,在 电极(填“X”或“Y”)周围有固体沉积,该电极的电极反应式为 。
(4)若X、Y均为Pt,B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)。恢复到常温下,B电池溶液的pH= ,要使该溶液恢复到原来的状态,需加入 (填物质并注明物质的量)。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为 。
(6)若X、Y均是Pt,电解质溶液为Na2SO4溶液,通电一段时间后,在阴极上逸出c mol气体,同时有N g Na2SO4•10H2O 晶体析出,若温度不变,此时剩余溶液的溶质的质量分数为 。
(学法题)通过以上题目,请总结书写电极反应式的关键 。
3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】
【实验装置】
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是 。
(2)反应装置中加干燥管是为了 。两个装置中冷凝管的作用 (填“相同”或“不相同”),冷却水进水口分别为 和 (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是 ,稀醋酸不能加多了,原因是 。用分液漏斗分离出酯层的操作叫 。碳酸钠溶液洗涤的目的是 。加碳酸钾的目的是 。
(4)采用减压蒸馏的原因是 。
(5)本实验所得到的3-丁酮酸乙酯产率是 (填正确答案标号)。
| A.10% | B.22% | C.19% | D.40% |
某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42−)中提取铬.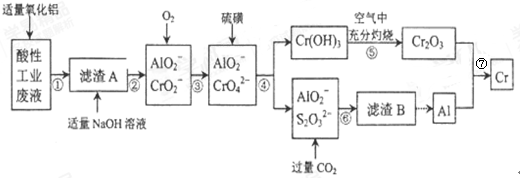
有关数据如表:
| 化合物 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| 完全沉淀的PH |
10.5 |
4.3 |
5.3 |
| 开始溶解的pH |
-- |
7.8 |
9.2 |
| Ksp近似值 |
10-12 |
10-14 |
10-31 |
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)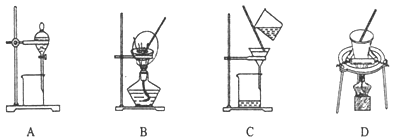
(6)步骤⑦中发生的化学反应方程式为____________________________。