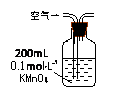
Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
| 序号 |
A |
B |
C |
| 装置 |
 |
 |
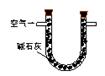 |
| 原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。

(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、Fe(NO3)3溶液
| 实验步骤 |
预期现象和结论 |
| |
|
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是__________________________________。
(2)方案二:按如图装置进行实验,并回答以下问题。
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀H2SO4装入分液漏斗中。D装置的作用是__________________________________________。
②实验中除称量样品质量外,还需分别称量______________装置反应前后的质量(填装置的字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是______________________________________。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤、干燥沉淀、称量固体质量、计算:
①实验中判断沉淀已完全的方法是__________________________________________
___________________________________________________________________________。
②如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________________________。
(9分)在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是。
(2)有白色沉淀生成,说明,
红色变浅说明。
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为______ mL,离子反应方程式为。
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为。
(6分)为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色褪去并同时产生少量气体。
实验二:取上述实验一后锥形瓶中清液,进行如下实验:
①该清液滴在有色布条上有极强的漂白作用。②该清液中滴加碳酸钠溶液产生白色沉淀。③该清液中滴加盐酸可产生大量气体。④该清液加热后变浑浊并产生大量气体。
回答下列问题:
(1)在实验二中,清液滴在有色布条上有极强的漂白作用说明该清液中含有_________(写化学式);清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有______离子;清液中滴加盐酸产生的气体是________;清液加热后产生浑浊的原因是因为生成了________。
(2)该学生通过上述实验,写出氯水和碳酸钙反应的化学方程式为:
。
(10分)某课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠含量,用如图所示装置.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2与NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3).
试回答:
(1)烧瓶B中盛 ,试管C中盛 .
(2)有同学认为可以省去某些装置,你认为怎样:能否省去乙装置? (填“能”或“不能”),理由是
(3)有同学认为还必须加入某些装置,你认为怎样?(填“需要”或“不需要”),如果你认为需要,请指出该装置的作用
(4)丁装置中冰水的作用是.
(11分)某学生欲配制6.0 mol/L的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:
①480 mL 0.5 mol/L 的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________
_________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意
。