A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
| A |
单质在自然界中硬度最大 |
| B |
原子中s能级与p能级电子数相等且有单电子 |
| C |
C同在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D |
单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E |
单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物 |
(1)写出A元素基态原子的价电子排布图 。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:
(2)常温下,某气态单质甲分子与AB分子核外电子数相等,则一个甲分子中包含 个π键,在A—H、B—H两种共价键中,键的极性较强的是 (用元素符号表示)。D元素原子核内中子数比质子数多1,则D原子可以表示为 ,其原子核外有 种运动状态不同的电子。
(3)B的氢化物的熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是
。
(4)通常情况下,A的燃烧热为a kJ ·mol-1,C的燃烧热为b kJ ·mol-1,则C与AO2反应生成A的热化学方程式为 。
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题: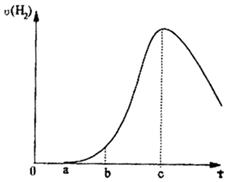
曲线由0→a段不产生氢气的原因____________________,
有关的离子方程式为___________________________;曲线由a→b段产生氢气的速率较慢的原因________________;
曲线由b→c段,产生氢气的速率增加较快的主要原因___________;
曲线由c以后,产生氢气的速率逐渐下降的主要原因____________。
根据提供条件推断元素,并按要求填空:原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式 ________ ,最高价氧化物对应水化物化学式 ________ ,其最高价氧化物对应水化物与NaOH反应的化学方程式为 ___________________________。
第3周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式为______________,最高价氧化物对应水化物与氢氧化钠反应的化学方程式为 _______________。
原子序数依次递增的同周期四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 _______、 ________、 ________、 ________ 。
某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧质量分数为60%。则该元素最高价氧化物的化学式为 ________ 。
当一个化学反应中反应物总能量大于生成物总能量时,此反应为_______反应(吸热或放热),酸碱中和是____________反应(吸热或放热)。
氯原子的质量数为37,中子数为20,那么它的核外电子数是__________,质子数是__________。
具有相同 和不同 的同一种元素的原子互称为同位素。