下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L—1盐酸、③0.1 mol·L—1氯化镁溶液、④0.1 mol·L—1硝酸银溶液中,Ag+浓度:①>④=②>③ |
| D.用0.2000 mol·L—1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol·L—1),至中性时,溶液中的酸未被完全中和 |
下列有关金属腐蚀与防护的说法正确的是
| A.金属腐蚀包括化学腐蚀和电化学腐蚀两种,其中化学腐蚀更为普遍 |
| B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| C.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| D.可将地下输油钢管与外加直接电源的正极相连以保护它不受腐蚀 |
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:Ag2O+Zn+H2O 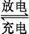 2Ag+Zn(OH)2在此电池放电时,负极上发生反应的物质是
2Ag+Zn(OH)2在此电池放电时,负极上发生反应的物质是
| A.Zn | B.Ag | C.Ag2O | D.Zn(OH)2 |
碱性电池具有容量大、放电电流大的特点,得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+ MnO2(s)+H2O(l)="=ZnO" (s)+Mn(OH)2 (s) ,下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池工作时,电子由正极通过外电路流向负极 |
| C.电池正极的电极反应式为:MnO2(s)+ 2H2O(1)+2e— = Mn(OH)2 (s) +2OH—(aq) |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
在用Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是
| A.锌片是正极,铜片上有气泡产生 |
| B.溶液中H2SO4的物质的量减少 |
| C.电流方向是从锌片流向铜片 |
| D.电解液的pH保持不变 |
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为
| A.a>b>c>d | B.c>a>b>d | C.a>c>d>b | D.b>d>c>a |