(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下呈液态,而FeCl3可用升华法提纯,则两种氯化物均属于 晶体。
(3)SO42—和 S2O82—(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A.SO42—中存在σ键和π键且与PO43—离子互为等电子体
B.S2O82—中存在非极性键且有强氧化性
C.S2O82—比SO42—稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。
锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下: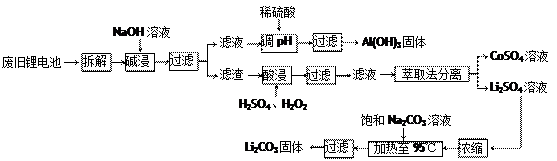
(1)上述工艺回收到的产物有Al (OH)3、。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是。
(3)酸浸时反应的化学方程式为。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是。
(4)生成Li2CO3的化学反应方程式为。已知Li2CO3在水中的溶解度随着温度的升高而减小,所以在浓缩结晶后要过滤。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双 氧水反应,生成氮气和水蒸气,放出256.6KJ的热量。
氧水反应,生成氮气和水蒸气,放出256.6KJ的热量。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是KJ。
(3)肼与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20%---30%的氢氧化钾溶液,写出该电池放电时的电极反应:
正极负极
铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 ="=" 2PbSO4+ 2H2O,据此判断:
(1)铅蓄电池的负极材料是________。
(2)工作时正极反应为________________________________。
(3)工作时,电解质溶液的PH________(填“增大”、“减小”或“不变”)
(4)工作时,电解质溶液中阴离子移向________极;电流方向从________极流向________极。(填正,负)
下表是元素周期表的一部分,回答下列有关问题
(1)写出下列元素符号:① ________,⑥ ________。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(用化学式表示)
(3)已知⑦的一种单质具有强氧化性,能使淀粉碘化钾式纸变蓝,化学方程式为,
O3+2KI+H2O=2KOH+I2+O2当生成1.27克碘时,转移的电子数为.
将铝片和镁片用导线连接插入氢氧化钠电解质溶液中,写出该装置中负极的电极反应式和总反应的离子方程式。
(1)负极反应式总反应离子方程式