某学生学习了双氧水制氧气的实验后,想起自己家里也有一瓶消毒用双氧水,由于标签已部分受损无法判断其是否变质,所以他将该瓶溶液带到学校,进行了如下图所示的研究。试回答:
(1)放入二氧化锰的作用是___________________
(2)如果该溶液未变质,应该观察到的现象是__________ ________,若不能观察到上述现象,说明该瓶双氧水已经变质成________________。
(3)将未过期的这种双氧水滴在伤口上,会迅速出现大量气泡,你认为该气体可能是_______
⑷通过以下两种操作都可以产生氧气:①把二氧化锰加入装有过氧化氢(H2O2)溶液的试管中;②把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中。要得到平稳的氧气流,你所选用的操作是__________(填序号),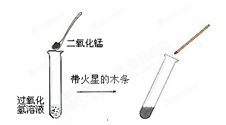
通过一年的学习,我能用学到的化学知识解决许多问题。
(1)衣服上的油污,可以用汽油洗净,其原理是;
也可以用加了洗涤剂的水洗净,其原理是。
(2)杀菌剂波尔多液是用硫酸铜、熟石灰加水配制而成的。用化学方程式解释不能用铁制容器配制波尔多液的原因:。(填化学方程式)
2008年5月12日汶川大地震牵动全周人民的心,灾区饮水安全成为人们关注的重要问题。请你运用以下资料及所学的化学知识,为灾区人民提供饮水安全常识。
【资料在线】我国生活饮用水的标准
| 感官指标 |
化学指标 |
细菌学指标 |
| 水质无色无味 且澄清透明 |
pH 6 5~8.5;总硬度<250mg/L。 (以碳酸钙计);铜<l 0mg/L,……等 |
细茵总数<100个/mL等 |
(1)除去水中难溶性的固体物质可用___________的方法。
(2)①测定水样的pH可选用_________(填标号)
A.酚酞溶液 B. pH试纸 C.石蕊溶液
②检验水样是硬水还是软水,可用的物质是___________
(3)符合感官和化学指标的水还不一定是安全的饮用水,理由是_________________。
化学就在我们身边,它能改善我们的生活。请从①活性炭②一氧化碳③甲烷④小苏打⑤熟石灰⑥钛合金中选择适当物质的序号填空
(1)发酵粉可以使食品松软可口,属于发酵粉成分之一的是;
(2)常用来改良酸性土壤的碱是;
(3)可用来除去冰箱异味的是;
(4)天然气、沼气中的主要成分;
(5)吸烟对人体有害。燃着的香烟产生的烟气中含有一种能与血液中血红蛋白结合的有毒气体,它是;
(6)可制造人造骨的是。
如果不小心将浓硫酸弄到皮肤上,应该。
①二个氮气分子;②三个硫酸根离子;③石灰石的主要成分