下列说法不正确的是( )
| A.64g氧气中含氧分子数为2NA |
B.1.7g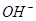 中所含的电子数为NA 中所含的电子数为NA |
| C.49g硫酸中所含氧原子数为2NA |
| D.58.5g氯化钠中所含的离子数为NA |
下列变化需加入还原剂才能完成的是(→代表转化)
| A.MnO2→MnO4- | B.CO2→HCO3- | C.HS-→S2- | D.NO3-→NO |
学习化学过程中需要经常做实验。下列实验操作正确的是
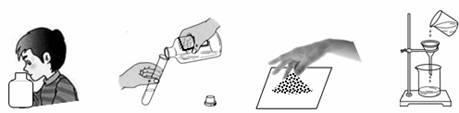
| A.闻气味 | B.倾倒液体 | C.取粉末 | D.过滤 |
阿斯匹林(分子式为C9H8O4)是人们熟知的治感冒药,具有解热镇痛作用。它的摩尔质量是
| A.148g | B.148g/mol | C.180g/mol | D.146g |
摩尔是
| A.国际单位制的一个基本物理量 | B.物质质量的单位 |
| C.物质的量的单位 | D.表示6.02×1023个粒子的集体 |
室温时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
| A.若PH>7时,则一定是c1v1=c2v2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2>c1 |
| D.若V1=V2,C1=C2,则c(CH3COO-)+C(CH3COOH)=C(Na+) |