有两个极易导热的密闭容器a和b(如图所示),a容器体积恒定,b容器压强恒定。在同温同压和等体积条件下,向a和b两容器中通入等物质的量的NO2,发生反应: 2NO2 N2O4△H<0,则以下说法正确的是
N2O4△H<0,则以下说法正确的是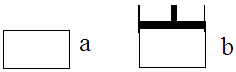
| A.反应起始时两容器的反应速率va和vb的关系:va<vb |
| B.反应过程中两容器内的反应速率va和vb的关系:va<vb |
| C.反应达到平衡时,两容器内压强相同 |
| D.反应达到平衡时,两容器的NO2的转化率相同 |
下列说法中不正确的是:
| A.元素电负性越大的原子,吸引电子的能力越强 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.在晶体钋(简单立方堆积)中,每个钋原子周围紧密相邻的钋原子有8个 |
| D.CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为配位键 |
下列说法不正确的是
| A.用价层电子对互斥理论预测H2S和BF3的立体结构为:V形和平面三角形 |
| B.分子晶体中一定存在分子间作用力,不一定存在共价键 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化 |
具有相同价电子数和相同原子数的分子或离子间互称为等电子体,下列粒子不属等电子体的是
| A.SO2和O3 | B.H2O2和HCl |
| C.NH2-和H2O | D.CH4和NH4+ |
设NA为阿伏加德罗常数,下列叙述中正确的是
| A.12.4g白磷晶体中含有的P-P键数是0.4NA |
| B.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA |
| C.2 mol SO2和1 molO2在一定条件下的密闭容器中反应,反应后分子总数大于2 NA |
| D.1mol甲醇中含有C—H键的数目为4NA |
根据电子排布的特点,Ar在周期表属于
| A.s区 | B.p区 | C.d 区 | D.ds区 |