在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的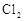 约有三分之一与水反应。请回答下列问题:
约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________________;
(2)估算该反应的平衡常数________________(列式计算,写明解题过程,否则不得分);
(3)在上述平衡体系中加入少量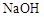 固体,平衡将向________移动;
固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”“减少”或“不变”),平衡将向_________移动。
(5)氯气溶于水达到饱和后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c( )减小 )减小 |
| B.通入少量HCl,溶液漂白性增强 |
C.加入少量固体NaOH,一定有c(Na+)=c(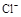 )+c( )+c( ) ) |
| D.加入少量CaCO3,溶液漂白性增强 |
(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为 ,B的元素名称为 ;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是 
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则氢负离子H-的第一电离能为
现有下列物质, 请用字母填空:
| A.干冰 | B.金刚石 | C.氦 | D.晶体硅 E.过氧化钠 F.二氧化硅 G.氯化铵 |
(1)属于原子晶体的化合物是 ,
(2)固态时不含化学键的分子晶体是 
(3)含有非极性键的离子化合物是 。
(4)含有离子键、共价键、配位键的化合物是 。
卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I),请预测下列物质的性质:
(1)熔点: F2Cl2(填“<”或“=”“或>”,下同),沸点:HFHCl,一定压强下HF和HCl的混合气体降温时(填HF或HCl)先液化。
(2)分解温度:HFHCl,熔点:NaFSiF4
.已知醛在一定条件下可以发生如下转化: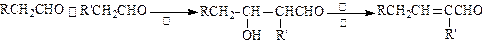
物质B是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中各有机物的转变关系回答问题: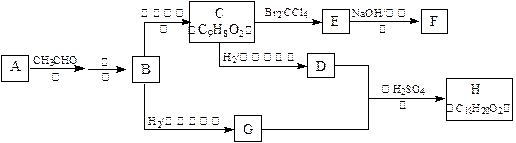
(1)A、B的结构简式为:A__________________,B_________________。
(2)G、D反应生成H的化学方程式是:___________________________。
(3)一定条件下,能够与1mol F发生反应的H2的最大用量是:_______ mol。
(4)G有多种同分异构体,其中能与金属反应且苯环上只有一个取代基的同分异构体的结构简式为:_______________、_________________、__________________、__________________。
有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,回答:
⑴ 满足题干条件的A应与乙酸具有相同的___________________
(2) 若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
(3)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
(4)若A分子中氧元素质量分数为13.33%,其余为C、H且其原子个数比为1:1,,且A的相对分子质量小于200,则A的分子式为___________。