有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,回答:
⑴ 满足题干条件的A应与乙酸具有相同的___________________
(2) 若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
(3)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
(4)若A分子中氧元素质量分数为13.33%,其余为C、H且其原子个数比为1:1,,且A的相对分子质量小于200,则A的分子式为___________。
(14分)A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为。
(3)C、D、E元素的第一电离能由大到小的顺序是。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为,C离子的配位数是。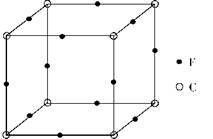
汽车尾气净化反应:2NO(g)+2CO(g) N2(g)+2CO2(g),请回答下列问题:
N2(g)+2CO2(g),请回答下列问题:
(1)对于气相反应,用某组分B平衡时的分压p(B)代替物质的量浓度c(B)也可表示平衡常数,记作KP,则该反应的平衡常数KP表达式为;
(2)已知:N2(g) + O2(g) ="2NO(g)" △H=+180.5kJ·mol-1
C(s) + O2(g) = CO2(g)△H=-393.5 kJ·mol-1
2C(s) + O2(g) ="2CO(g)" △H=-221kJ·mol-1
则2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=,该反应能自发进行的条件(填“高温”、“低温”或“任意温度”);
N2(g)+2CO2(g)的△H=,该反应能自发进行的条件(填“高温”、“低温”或“任意温度”);
(3)在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol。
①若保持体积不变,再向容器中充入n(CO2)=" b" mol,n(NO)=" a" mol,则此时v正v逆(填“>”、“=”或“<”);
②在t2时刻,将容器迅速压缩到原容积的1/2,在其它条件不变的情况下,t3时刻达到新的平衡状态。请在下图中补充画出t2-t3-t4时段N2物质的量的变化曲线。
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在左右;
②目前对氮氧化物(NOx)进行治理的方法比较多,其中吸附/吸收法广受欢迎。下列物质适合作为NOx吸收剂的是
A.活性炭 B.氨水C.酸性尿素溶液D.硫酸
I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期。相关信息如下:
| 相关信息 |
|
| X |
单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y |
含Y元素的物质焰色反应为黄色 |
| Z |
同周期元素中原子半径最小 |
| R |
R元素原子的最外层电子数是K层电子数的3倍 |
(1)Z元素在周期表的位置是,Y、Z、R简单离子的半径从大到小的顺序是(用离子符号表示);
 (2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为;
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为,写出乙溶液在空气中变质过程的化学方程式。
II.元素X与氢可形成多种化合物,如丙、丁、戊。
(4)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸。8.6 g丙爆炸分解生成H2和6.72 L(标况下)X2。写出其爆炸的化学方程式;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76 g·L-1,则物质丁的化学式为;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)。
【化学—选修3物质结构与性质】
(1)元素的第一电离能:NO(填“>”或:“<”)
(2)基态Fe2+的电子排布式为。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
则该元素的元素符号是。
(4)NO3-的空间构型(用文字描述),SO42-中S原子的杂化方式为。
(5)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如下图所示,呈现这种变化关系的原因是。
(6)金属铜原子的堆积方式为面心立方最密堆积,铜的原子半径为r nm,则铜晶胞的体积表达式为cm3。
【化学—选修2化学与技术】技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如下图:
(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式)。
(2)沉淀池中发生反应的化学方程式________________,煅烧炉中发生反应的化学方程式是_______________________。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是,加入细小食盐颗粒的作用是________________。
(4)写出路布兰制碱法的反应原理中属于氧化还原反应的化学方程式,该法与侯德榜制碱法相比的缺点是(写出两点即可)
(5)候氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中的纯度表达式为:。