X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。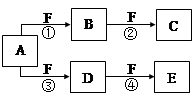
回答下列问题:
(1)A的电子式为 。
(2)A和E反应生成G,C与G中都含有 (填化学键的类型)。
(3)反应③中如果转移的电子为3 mol,则被氧化的A为 mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式: 。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO4-形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为: 。
金刚烷(可以看成四个等同的六元环组成的空间构型)是一种重要的化工原料,工业上
可通过下列途径制备: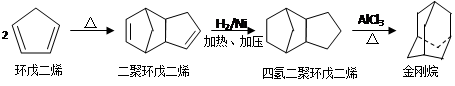
请回答下列问题:
(1)环戊二烯分子中最多有____________个原子共平面;
(2)金刚烷的分子式为_______________,其分子中的—CH2—基团有__________个;金刚烷的二氯代物的数目是______。
(3)下面是以环戊烷为原料制备环戊二烯的合成路线: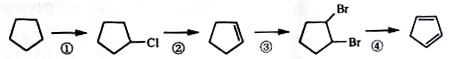
其中,反应①的产物名称是_________________,反应②的反应试剂和反应条件_____________,反应③的反应类型是___________;
A B C
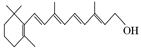
(1)图A是由4个碳原子结合成的某种烷烃(氢原子没有画出)。
①写出该有机物的系统命名法的名称 。
②该有机物的同分异构体的核磁共振氢谱中应有 个峰。
(2)图B的键线式表示维生素A的分子结构。
①该分子的化学式为 。
②1 mol维生素A最多可与 mol H2发生加成反应。
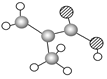
(3)某物质只含C、H、O三种元素,其分子模型如图C所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
①该物质的结构简式为
②该物质中所含官能团的名称为 和
有机物分子HO—CH2CH = CHCH2—COOH含有多种官能团;
⑴写出其中一个官能团的名称
⑵它能与金属钠反应生成含钠的化合物和H2,写出含钠的化合物的结构简式
⑶它能在浓H2SO4存在下与酸或醇或自身分子间发生多种形式的酯化反应,写出它跟乙酸或它跟乙醇反应生成的酯的结构简式 ,(只写一个)浓H2SO4的作用是 。(写主要的作用)
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: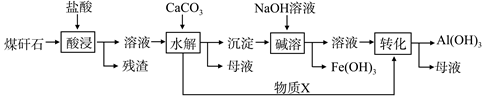
(1)“酸浸”过程中主要反应的离子方程式为__________ 、____________。
(2)“酸浸”时铝浸出率的影响因素可能有_____ ________、_____ ______。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的主要离子方程式为:Fe3++3OH- = Fe(OH)3↓; 。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下: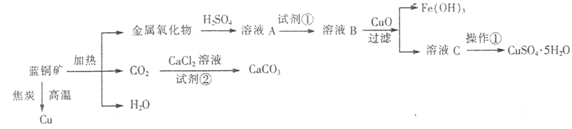
已知:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
|
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式 。
(2)从下列所给试剂中选择:实验步骤中试剂①为 (填代号)。
a.KMnO4b.K2Cr2O7c.H2O2d.氯水
(3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至 时停止加热。
(5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是 (填代号);
a.氨水 b.盐酸 c.水蒸气 d.NaOH溶液
如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因 。
(6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为 。