(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出当有1molCO反应时,理论上CO(g)还原FeO(s)所吸收的能量是:
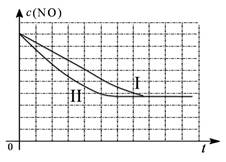
(2)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验,实验条件已经填在下面实验设计表中。2NO + 2CO ⇋N2 + 2CO2 △H< 0
| 实验编号 |
T(℃) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| Ⅱ |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
| Ⅲ |
350 |
1.20×10-3 |
5.80×10-3 |
124 |
①以上三组实验的实验目的是 。
②请在给出的坐标图中,画出上表中的第三个实验条件
下混合气体中NO浓度随时间变化的趋势曲线图。
(3)汽车内燃机工作时引起反应:N2(g)+O2(g)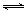 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃ 时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数K及N2的转化率(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃ 时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数K及N2的转化率(写出计算过程)。
保护环境是我们共同关注的社会问题。
(1)当空气受SO2污染时,可通过飞机喷洒X粉末,使空气中的SO2含量降低,该过程发生的反应是:2X +2SO2+O2==2CaSO4 +2CO2,X的化学式为 。
(2)为限制二氧化碳的排放,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为乙烯(C2H4)和水,该反应的化学方程式为 。
(3)煤的气化过程会产生物质A和B, A和B在一定条件下反应生成C和D,微观过程如下图所示。该反应中,B和C的质量比为 。物质C是一种清洁燃料,其完全燃烧的化学方程式为 。
二氧化氯(ClO2)是一种环保型杀菌消毒剂。在生活中主要用于饮用水的消毒和食品保鲜。用二氧化氯消毒后的水可以直接饮用。
二氧化氯是一种黄绿色、有刺激性气味的有毒气体,密度比空气大,其熔点为-59℃,沸点为11.0℃,易溶于水,且与水反应得到酸性溶液。该气体具有强烈的腐蚀性,吸入高浓度二氧化氯气体会引起咳嗽和呼吸道粘膜的损伤。
二氧化氯极其不稳定,受热或见光易发生爆炸性分解,直接造成氯气泄漏而污染环境,所以只有依靠现场制备。工业上用稍潮湿的氯酸钾(KClO3)和草酸(H2C2O4)在60℃时反应制得。由于制取二氧化氯需要使用的氯酸钾是易爆危险品,所以制备和运输成本很高,因此我国目前还未广泛用其消毒自来水。
请依据文章回答下列问题:
(1)本文介绍了二氧化氯的性质、制法和 等方面内容。
(2)二氧化氯的化学性质有① ;② 。
(3)请将制备二氧化氯反应的化学方程式填写完全:
2KClO3 + 2H2C2O4 2ClO2↑+ 2CO2↑ + K2C2O4 +
2ClO2↑+ 2CO2↑ + K2C2O4 +
(4)发生二氧化氯泄漏时,紧急处理方法是 。
A—I是初中化学中常见的物质。它们之间有如下图所示的转化关系。已知A为铝土矿的主要成分,通常情况下F是一种液体,C、D、H、I为气体,H能参与绿色植物的光合作用,G为黑色固体。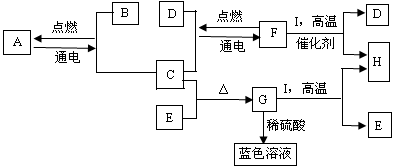
请回答下列问题:
(1)G的化学式是 。
(2)H + 单质碳→I,其反应条件是 。
(3)A 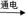 B + C的化学方程式是 。
B + C的化学方程式是 。
(4)I + F(气体) H+D的化学方程式是 。
H+D的化学方程式是 。
现有三瓶失去标签的无色溶液盐酸、氯化钠溶液和澄清石灰水,
(1)往三种无色溶液中加入某种指示剂即可区别它们,该指示剂可选用
(2)装澄清石灰水的试剂瓶口常出现白膜,白膜主要成分的化学式是
(3)上述溶液中属于盐溶液的是
甲为人体吸入空气和呼出气体成分对比图。CO2含量变化真有这么大?
(1)利用图乙所示 法收集一瓶呼出的气体,标上A;取一个同样装有空气的集气瓶,标上B。将两根同样的小木条点燃后同时伸入A瓶和B瓶,A瓶中的木条先熄灭。这个实验现象 (选填“能”或“不能”)说明呼出的气体中二氧化碳更多。
(2)用大针筒将100ml人体呼出气体压入20ml澄清石灰水中(如图丙),澄清石灰水变浑浊;用同样的方法将100ml空气压入另一瓶20ml澄清石灰水中,请说出澄清石灰水是否变浑浊并解释原因: 。