肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(KJ)是( )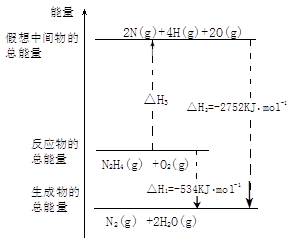
| A.194 | B.391 | C.516. | D.658 |
在以下四种溶液中,各离子一定能大量共存的是
| A.滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl—、CO32— |
| B.含溶质为MgCl2的溶液:K+、NO3—、SO42—、Al3+ |
| C.水电离出来的c(H+)=10—13mol/L的溶液:K+、Na+、HCO3—、Br— |
| D.pH=1的溶液: Fe2+、Na+、I—、NO3— |
 向体积为 Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
向体积为 Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+) |
B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-) |
C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+) |
D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-) |
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O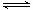 HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.稀释溶液,水解平衡常数增大 | B.通入CO2, 平衡朝正反应方向移动 |
C.升高温度,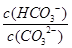 减小 减小 |
D.加入NaOH固体,溶液pH减小 |
pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b的关系为
| A.a>b | B.a=10-4b | C.b=10-4a | D.a=b |
燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质溶液是强碱。下面关于甲烷燃料电池的说法正确的是
| A.负极反应为:O2+2H2O+4e ==4OH-; |
| B.负极反应为:CH4+10OH- - 8e==CO32-+7H2O |
| C.放电时溶液中的阳离子向负极移动; |
| D.随放电的进行,溶液的pH值不变 |