写出与下列离子方程式相对应的化学方程式:
(1)H++OH—=H2O
(2)Ba2++SO42—=BaSO4↓
(3)Fe+2H+=Fe2++H2↑
(4)Fe3++3OH—=Fe(OH)3↓
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g)  Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |
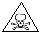 |
| 储运要求 |
远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。
③ 氯气含量检测仪工作原理示意图如下: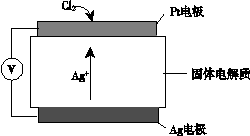
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:
(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
高分子化合物PPTA树脂、PF树脂、脲醛树脂合成路线如下。
已知:I. R—NH2 +  R—NHCOCH3 + CH3COOH (R为烃基)
R—NHCOCH3 + CH3COOH (R为烃基)
(乙酸酐)
II. 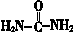 (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子。
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子。
(1) 由苯合成A 的化学方程式是。
(2) →B的反应类型是。
→B的反应类型是。
(3)条件a选择的化学试剂是。
(4)E中有两种不同化学环境的氢原子,PPTA树脂的结构简式是。
(5)高分子化合物PF树脂的单体是苯酚和。
(6)W中只有一种含氧官能团。下列说法正确的是。
a. Y分子中只有一种官能团
b. M与HCHO互为同系物
c. W的沸点高于C2H6
(7)Y→W时,条件ⅰ、ⅱ转化的官能团分别是、。
(8)合成脲醛树脂的化学方程式是。

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是,工业上制取A的离子方程式Ⅰ为。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式;
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(6)Ⅰ①图中X、Y分别是(填化学式),分析比较图示中氢氧化钠质量分数a%b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应。
【化学与技术】
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。
(1)ClO2中所有原子(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用。
A饱和食盐水 B碱石灰 C浓硫酸 D蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是。
| A.二氧化氯可广泛用于工业和饮用水处理 |
| B.应用在食品工业中能有效地延长食品贮藏期 |
| C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围 |
| D.在工作区和成品储藏室内,要有通风装置和监测及警报装置 |
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学反应方程式为,此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是,此法相比欧洲方法的优点是。
(5)科学家最近又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为,此法提高了生产及储存、运输的安全性,原因是。
含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为________。
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该
反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆)
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。