现有①氧气;②空气;③碱式碳酸铜;④氯酸钾;⑤硫;⑥水;⑦氧化镁;⑧氯化钠等物质,其中属于单质的有(填序号)__________;属于化合物的有____________,其中____________属于含氧化合物,________属于氧化物;属于混合物的有________。
现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途。
(1)在高温下,氧化铁粉末发生铝热反应的化学方程式为____________。
(2)某学生拟用铝粉制备少量Al(OH)3,制备过程如下图所示:
请回答:
①通过操作a分离出Al(OH)3,操作a的名称是________。
②从Al(OH)3的性质考虑,用Al2(SO4)3溶液制备Al(OH)3时,常用氨水而不用NaOH溶液,请用
一个化学方程式表明其理由:______________。
(3)铝可以和烧碱溶液反应,该反应的离子方程式为______________。
(4)工业上冶炼的化学方程式为________;若生产2.7t铝,则转移电子的物质的量为_______。
化学反应与能量密不可分,回答下列问题。
(1)已知31g白磷变为31g红磷时释放能量。试回答:
①上述变化属于____化学(填“物理”或“化学”)变化。
②31g白磷的能量_____(“>”或“<”)31g红磷的能量。
(2)A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸:
①分别写出B、C装置中铁片表面发生反应的电极反应式:
B______________________,C____________________。
②一段时间后,C中产生3.36L(标准状况下)气体时,硫酸恰好消耗完。此时,三个烧杯中液体质量由大到小的顺序为________(填字母),稀硫酸的物质的量浓度为________mol/L。
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示: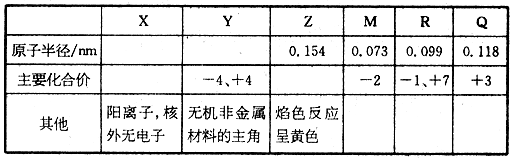
(1)R在自然界中有质量数为35和37两种核素,它们之间的关系互为__________,R在元素周期表中的位置是________。
(2)Z的单质与水反应的离子方程式是______________。
(3)Y与R相比,非金属性较强的是_______(用元素符号表示),下列事实能证明这一结论的是______(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是________。
有机物对香豆酸(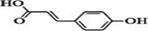 )主要用于配置香辛樱桃、杏、蜂蜜等香料。
)主要用于配置香辛樱桃、杏、蜂蜜等香料。
(1)写出对香豆酸的分子式 。
(2)下列关于对香豆酸的说法不正确的是 。
a.能与NaOH溶液反应
b.能发生加成、取代、银镜反应
c.加金属钠,有氢气生成
d.加FeCl3溶液,溶液发生显色反应
(3)对香豆酸的某种同分异构体丁,可用于除草剂苯嗪草酮的中间体,其可通过下图转化关系制得。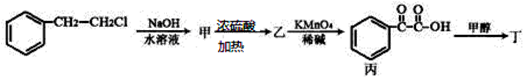
①乙→丙的反应类型 ;
②乙分子所含官能团是 (填名称);
③丙→丁的反应化学方程式: ;
(4)有机物戊与丁互为同分异构体,且满足以下特点:
①是苯的对位取代物,
②能与NaHCO3反应放出气体,
③能发生银镜反应。
请写出化合物戊的结构简式 (任写一个即可)。
利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳
光照转化成为四环烷(Q)的反应为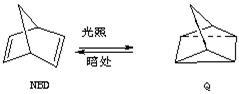
△H=+88.62 kJ/mol
(1)以下叙述错误的是 (填序号)
a.NBD的能量比Q的能量高 b.NBD和Q互为同分异构体
c.NBD的分子式为C7H8d.NBD能使溴水褪色
(2)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为 。若用氘(D)原子取代NBD分子中的一个H原子,可得到的同分异构体共有_________种。
(3)NBD分子可聚合生成高分子化合物,试写出反应的化学方程式 。