可逆反应: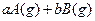

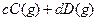 ,取
,取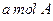 和
和 置于V L容器内。1分钟后,测得容器内A的浓度为
置于V L容器内。1分钟后,测得容器内A的浓度为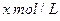 ,这时B的浓度为__ _ _ _ _ _ ______
,这时B的浓度为__ _ _ _ _ _ ______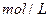 ,C的浓度为___ _ _ _ ____
,C的浓度为___ _ _ _ ____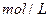 。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ ____ _。
。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ ____ _。
9.5gMgCl2固体溶于水配成500mL溶液,其浓度为mol·L-1,从中取出100mL溶液,其中Cl-的浓度为mol·L-1;
再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为mol·L-1。
(10分)甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)  CO2(g)+3H2(g) ΔH>0。
CO2(g)+3H2(g) ΔH>0。
(1)在一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为________。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为a L。试回答:
①反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为________,A、B两容器中H2O(g)的体积百分含量的大小关系为B________A(填“>”“<”或“=”)。
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验 编号 |
HA物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶 液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组实验分析,HA是________(填“强酸”或“弱酸”)。
(2)②组实验表明,c________0.2(填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是__________________。
(3)从③组实验结果分析,说明HA的电离程度______(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_______________________。
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)- c(HA)=_________mol/L
(8分)下图中是电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是惰性电极。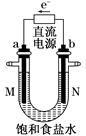
(1)a电极的名称___________________________________________。
(2)电解过程中观察到的现象_________________________________。
(3)确定N出口的气体最简单的方法是_________________________。
(4)电解的总反应离子方程式为___________________________________。
(5)若将b电极换成铁作电极,写出在电解过程中U形管底部出现的现象___________________。
(10分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_______________;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为__________________。