甲烷自热重整是先进的制氢方法, 包含甲烷氧化和蒸气重整。向反应系统同时通入甲烷、氧气和水蒸气, 发生的主要化学反应有:

回答下列问题:
(1)反应CO(g)+H2O(g)  CO2(g)+H2(g)的ΔH= kJ·mol-1。
CO2(g)+H2(g)的ΔH= kJ·mol-1。
(2)在初始阶段, 甲烷蒸气重整的反应速率 甲烷氧化的反应速率(填“大于”、“小于”或“等于”)。
(3)对于气相反应, 用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp), 则反应CH4(g)+H2O(g) CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析, 甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下, 温度、压强对H2和CO物质的量分数的影响如下图:
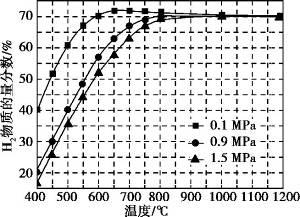
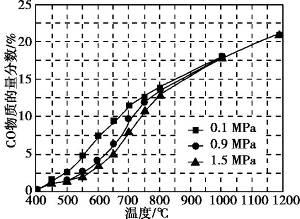
①若要达到H2物质的量分数>65%、CO物质的量分数<10%, 以下条件中最合适的是 。
A.600 ℃, 0.9 MPa B.700 ℃, 0.9 Mpa
C.800 ℃, 1.5 MPa D.1 000 ℃, 1.5 MPa
②画出600 ℃, 0.1 MPa条件下, 系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
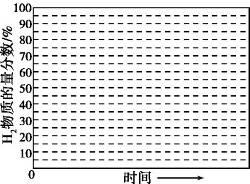
(6)如果进料中氧气量过大, 最终导致H2物质的量分数降低, 原因是 。
在一块大理石(主要成分是CaCO3)上,先后滴加①1mol/LHCl溶液和②0.1mol/LHCl溶液反应快的是滴加了____ _________的(填序号,下同),先后滴加同浓度的③热盐酸和④冷盐酸,反应快的是滴加的,用⑤大理石块和⑥大理石粉分别跟同浓度的盐酸起反应,反应快的是用了的。
离子键的强弱主要决定于离子半径和离子的电荷值。一般规律是:离子半径越小,电荷值越大,则离子键越强。试分析:①K2O②CaO③MgO 的离子键由强到弱的顺序是
下列气体
| A.CO | B.CH4 | C.H2 | D.H2S在空气中充分燃烧后其生成物既可使无水CuS04变蓝,又可使澄清石灰水变浑浊的是. |
元素X位于IA族,原子核内没有中子,Y元素原子的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是________,它是通过___ _____键结合的,用电子式表示它的形成过程:。
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。A、B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol·L—1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。 C的最高价氧化物的水化物是所有含氧酸中酸性最强的;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件回答:
(1)元素C位于第__________周期第__________族,它的最高价氧化物的水化物的化学式为____________。
(2)A元素是_______,B元素是______,D元素是______。(写元素符号)
(3)A与D形成的原子个数比为2:1的化合物的化学式是___ _ ____,
用电子式表示它的形成过程
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,
其离子方程式为______________________________ __________________。