丁达尔现象是区分胶体与溶液的一种最常用的方法。
(1)如图是在实验室中进行氢氧化铁胶体丁达尔现象实验的示意图,该图中有一处明显错误是___________,原因是_______________________(试从分散系的分类进行讨论说明)。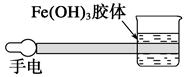
(2)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是______,理由是__________ 。
(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,其中最简单、最环保的方法是__________________________________。
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下,回答下列问题: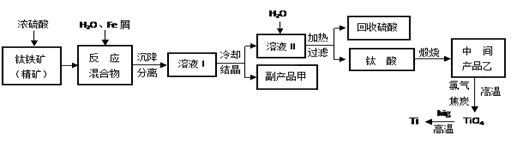
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲俗称“绿矾”其化学式是________________。
(2)上述生产流程中加入Fe屑的目的是(用离子方程式表示),检验副产品甲是否变质的实验方法是。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
| Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于_________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:__________________________________________________________________
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应控制的反应条件是__________________________
(6)在800--1000℃时电解TiO2也可制得海绵钛,装置如图所示。图中b是电源的______极,阴极的电极反应式________________。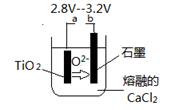
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。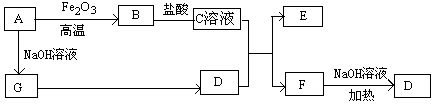
请回答下列问题:
(1)写出F的电子式:
(2)①C溶液与D反应的离子方程式为
②F溶液与NaOH溶液共热反应的化学方程式为
(3)①请用离子方程式解释C溶液为何显酸性
②F溶液中离子浓度由大到小的顺序为
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)=mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度(填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为(用含a的代数式表示)
(1)乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药。乙酰水杨酸的结构简式为 。
。
现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1 mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
①写出乙酰水杨酸与NaOH溶液反应的化学方程式 ;
②计算出产品纯度为(只需列出计算表达式,不必化简。乙酰水杨酸相对分子质量为180)。
(2)甲醇直接燃料电池具有启动快、效率高、能量密度高等优点。(已知二甲醚直接燃料电池能量密度E =8.39 kW·h·kg-1)。
①若电解质为酸性,甲醇直接燃料电池的负极反应为;
②该电池的理论输出电压为1.20 V,能量密度E = (列式计算。能量密度 = 电池输出电能/燃料质量,lkW·h = 3.6×106J,一个电子的电量=1.6×10-19C)。
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3-D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) |
91 :9 |
1 :1 |
1 :91 |
| pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:
① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
如图所示的装置中发生反应2A2(g)+B2(g)2C(g);△H=" -a" kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题:
(1)此反应的平衡常数表达式为______________________;若将温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(2)比较大小:w1_____ w2(填>、=、<),a、b、c由大到小的关系 ______________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将______________________(填增大,减小或不变)。
(4)若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3 mol/L,则 w1,w3的关系______________________。
(5)能说明A中已达到平衡状态的是(填序号,有一个或多个选项符合题意)。
a、v(C)=2v(B2)
b、容器内气体压强保持不变
c、容器中气体的平均相对分子质量不随时间而变化
d、容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂