在水溶液中能大量共存的离子组是
| A.Mg2+、NH4+、Cl—、OH— | B.Na+、AlO2—、CO32—、OH— |
| C.Ca2+、Fe3+、H+、NO3— | D.Fe3+、K+、SCN—、SO42— |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2和RY3,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01mol·L-1X和W形成化合物的水溶液pH为2,下列说法正确的是
| A.非金属性Y>R,则Y的最高价氧化物水化物的酸性高于R的最高价氧化物水化物的酸性 |
| B.在Z、Y形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C.原子半径由大到小排列的是:Z>R>W>Y>X |
| D.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
下列说法正确的是
| A.从盛有液溴的试剂瓶中取用溴时,不应倾倒而应将一洁净的长胶头滴管伸到瓶底吸取 |
| B.Fe3+既能与硫氰化钾反应生成血红色的配合物,又能与K4[Fe(CN)6]反应生成蓝色溶液 |
| C.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
| D.用标准NaOH标准液滴定盐酸,尖嘴部位滴定前无气泡,滴定后有气泡,则滴定结果偏大 |
下列说法正确的是
| A.化学反应速率的测定中,若反应物溶液有颜色,可用比色法测定溶液颜色的深浅,再根据溶液颜色与反应物浓度的关系,换算成反应物在不同反应时刻的浓度值 |
| B.泡沫灭火器是最常见的灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
| C.我国作为燃煤大国,酸雨的危害十分严重,安装烟气脱硫设施进行脱硫,吸收塔内浆液的pH值越高,越不利于SO2的吸收 |
| D.近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
在一定条件下,将4mol A充入体积不变的2 L密闭容器中,发生下述反应,: 2A(g) 2B(g)+C(g), 5 min后达到平衡,此时B的浓度为1.6 mol/L。下列判断正确的是
2B(g)+C(g), 5 min后达到平衡,此时B的浓度为1.6 mol/L。下列判断正确的是
A.反应在前5 min内,v(A)=0.16 mol/( L·min)
B.其他条件不变,若增大A的浓度,则达平衡时A的转化率会增大
C.其他条件不变,降低温度,平衡时n(B)=3mol,则反应的ΔH<0
D.平衡后移走2 mol B和1mol C,在相同条件下再达平衡时,c(A)<0.2 mol/L
室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,下列说法错误的是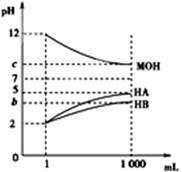
A.HA为强酸,HB为弱酸
B.若b+c=14,则MOH为弱碱
C.若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB
D.若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)=c(M+)