下列离子方程式中,书写正确的是
| A.铁片投入到稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| B.氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O |
| C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D.稀盐酸滴在石灰石上:CO32-+2H+=H2O+CO2↑ |
下列有关物质应用的说法正确的是
| A.SiO2具有导电性,可用于制造光导纤维 |
| B.体积分数为95%的酒精通常作为医用酒精 |
| C.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属 |
| D.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂 |
下列有关溶液中粒子浓度关系的比较中不正确的是
A.饱和氯水中滴加0.1 mol·L-1的NaOH溶液,溶液pH=7时:c(Na+)=2c(ClO-)+c(HClO)
B.已知HF的酸性比CH3 COOH的强,pH相等的NaF与CH3 COOK溶液中:c(Na+)-c(F-)=c(K+) -c(CH3COO-)
C.0.lmol/L pH为1的NaHB溶液中:c(Na+)>c(B2﹣)>c(H+)>c(OH﹣)
D.常温下,向20.00 mL 0.100 mol·L-1 NaA溶液中逐滴加入0.100 mol·L-1盐酸溶液的pH=7时:c(HA)=c(Cl-)>c(OH-)=c(H+)
工业上消除氮氧化物的污染,可用如下反应: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH=a kJ/mol在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g)ΔH=a kJ/mol在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表: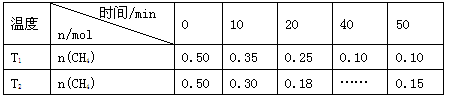
下列说法不正确的是
| A.10 min内,T1时CH4的化学反应速率比T2时小 |
| B.温度:T1<T2 |
| C.a < 0 |
| D.平衡常数:K(T1)<K(T2) |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.将0.1 molFeCL3溶液于1 L水中,所得溶液含Fe3+离子数目为0.1 NA |
| B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA |
| C.常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA |
| D.在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA |
能正确表示下列反应离子方程式的是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
| B.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| C.氢氧化镁与稀盐酸反应:H++OH-=H2O |
| D.Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |