某温度下在容积为2 L的密闭容器中,发生2X(g)+Y(g) 2W(g)的反应,当充入1 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是
2W(g)的反应,当充入1 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是
| A.若升高温度,W的体积分数减小,则该反应ΔH<0 |
| B.以Y的浓度变化表示的反应速率为0.01 mol/(L·s) |
| C.在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高 |
| D.增大压强正反应速率增大,逆反应速率减小,则平衡向正反应方向移动 |
如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是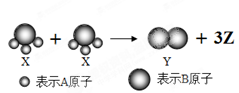
| A.根据质量守恒定律可推知,1个Z分子中含有2个A原子 |
| B.该反应属于分解反应 |
| C.该反应属于氧化还原反应 |
| D.X、Y、Z三种物质均属于非电解质 |
在两个密闭的容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是()
A.甲的分子数比乙的分子数多 B .甲的物质的量比乙的物质的量少[
.甲的物质的量比乙的物质的量少[
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
下列说法正确的是()
| A.80g SO3在标准状况下的体积为22.4 L |
| B.22.4 L O2中约含有6.02×1023个氧分子 |
| C.在标准状况下,20 mL NH3和60 mL N2所含的分子个数之比为1:3 |
| D.将80 g NaOH溶于1 L水中,所得溶质的物质的量浓度为2 mol/L |
提纯含有少量硝酸钡杂质的硝酸钾溶 液,可以使用的方法是()
液,可以使用的方法是()
| A.加入过量的碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
B. 加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| C.加入过量的硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| D.加入过量的碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
将氯化钠、乙醇、碘分别从以下三组混合物中分离出来:①氯化钠和水②乙醇和水③碘和水,宜采取的操作方法依次是()
| A.蒸发、蒸馏、萃取 | B.萃取、蒸馏、蒸发 |
| C.蒸发、萃取、蒸馏 | D.蒸馏、萃取、蒸发 |