(13分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.
(1)若用装置①制取NH3,其反应的化学方程式为_______________________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________________________________________.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是_____________________,分液漏斗中装的试剂是_________________,收集装置应选择________(填装置序号).
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积(标准状况)如下表:
试剂:6.0 g Ca(OH)2(s,过量),6.0 g CaO(s,过量),5.4 g NH4Cl(s),5.4 g (NH4)2SO4(s).
| 试剂组合 |
①Ca(OH)2 NH4Cl |
②Ca(OH)2(NH4)2SO4 |
③CaO NH4Cl |
④CaO(NH4)2SO4 |
| NH3体积( mL) |
1344 |
1364 |
1792 |
1753 |
从表中数据分析,实验室制氨气的产率(产率=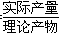 ×100%)最高的是________(填序号),其原因是_____________________________________________________________
×100%)最高的是________(填序号),其原因是_____________________________________________________________
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中 的物质的量浓度变化趋势为;
的物质的量浓度变化趋势为;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为;此时在B、C两装置中可能观察到得现象为。
(3)在(2)中滴加足量盐酸后,烧瓶内除 外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是(填“甲”或“乙”),
外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是(填“甲”或“乙”),
请说明另一方案不合理的原因。方案甲:取少量试样溶液于试管中,先加稀 ,再加
,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
(4)写出 固体加热到600℃以上分解的化学方程式。
固体加热到600℃以上分解的化学方程式。
利用下列实验仪器:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗
试剂:Na2CO3固体;标准NaOH溶液;未知浓度盐酸;Na2CO3溶液;蒸馏水。
进行下列实验或操作:
(1)做酸碱中和滴定时,还缺少的试剂是:
(2)配制250mL 0.1mol•L-1某溶液时,还缺少的仪器是:
(3)过滤时,应选用上述仪器中的(填编号)
(10分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。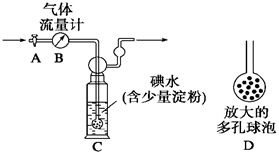
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式__________________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是__________________________________
______________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将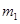 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。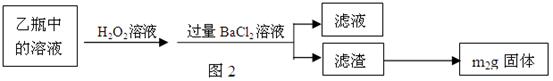
[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示: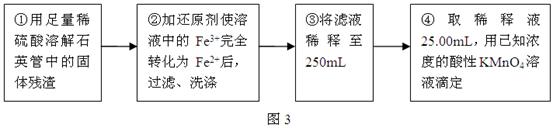
问题讨论: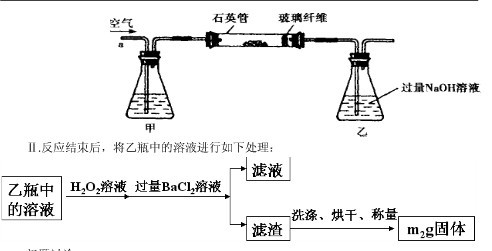
(1)Ⅰ中,甲瓶内所盛试剂是溶液。乙瓶内发生反应的离子方程式有:
、。
(2)Ⅱ中的滤渣在称量前还应进行的操作是。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有。
写出④中反应的离子方程式。
(5)该黄铁矿中硫元素的质量分数为。
(共14分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取及其相关实验的探究,回答下列问题.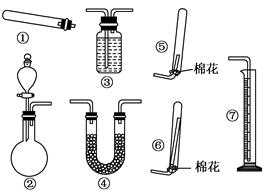
(1)若用装置①制取NH3,其反应的化学方程式为;若要测定生成的NH3的体积,则必须选择的装置是(填装置序号),装置中所盛试剂应具有的性质是.
(2)若用装置②制取并收集干燥的NH3,收集装置应选择(填装置序号).
(3)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1—10nm之间)。
①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是,试写出制纳米级碳酸钙的离子方程式;
②在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_____________________________。