用玻璃棒蘸取新制氯水滴在pH试纸中部,观察到的现象是( )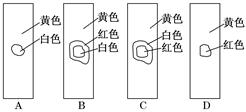
将甲烷和氧气的混合气体充入含有23.4 g Na2O2的密闭容器中,保持容器中温度为150 ℃,用电火花引燃充分反应后,压强为0 Pa,若将残留物溶于水,无气体逸出。据此判断下列叙述正确的是( )
| A.原混合气体中甲烷和氧气体积比为1∶2 | B.原混合气体中甲烷和氧气体积比为2∶1 |
| C.残留固体中只有NaOH | D.残留固体中只有Na2CO3 |
氢氧燃料电池已用于航天飞机。以30% KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:负极:2H2+4OH--4e-===4H2O;正极:O2+2H2O+4e-===4OH-;据此作出判断,下列说法中错误的是( )
| A.H2在负极发生氧化反应 | B.供电时的总反应为2H2+O2===2H2O |
| C.产物为无污染的水,属于环境友好电池 | D.燃料电池的能量转化率可达100% |
下列各组溶液中只用一种试剂(包括试纸)就能鉴别的是(允许加热)()
①FeCl2、Al(NO3)3、、MgSO4、NH4NO3溶液;②苯乙烯、溴苯、苯、乙醇
③MnO2、FeS、CuO、C四种黑色固体粉末;④NaCl、AlCl3、Ba(OH)2、HCl四种溶液
| A.只有①③ | B.只有①②③ |
| C.只有①③④ | D.①②③④ |
某有机物的结构为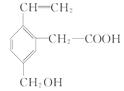 ,这种有机物不可能具有的性质是()
,这种有机物不可能具有的性质是()
| A.能使酸性KMnO4溶液褪色 |
| B.能发生酯化反应 |
| C.能跟NaOH溶液反应 |
| D.能发生水解反应 |
下列反应既属于氧化还原反应,又是吸热反应的是( )
| A.锌粒与稀硫酸的反应 | B.灼热的木炭与CO2反应 |
| C.甲烷在氧气中的燃烧反应 | D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |