为确定HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答: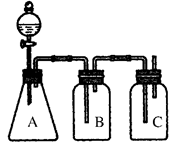
(1)锥形瓶A中装某可溶性正盐溶液,分液漏斗所盛试剂为___________________________。
(2)装置B所盛试剂是____________________,其作用是____________________________。
(3)装置C所盛试剂是________,C中反应的离子方程式是__________________________。
(4)由此可得出的结论是:酸性________>________>________。
下列装置不能完成的实验是
| A |
B |
C |
D |
|||||||||
| 装置 |
|
 |
 |
|
||||||||
| 实验 |
结合秒表测量锌与硫酸的反应速率 |
验证温度对化学平衡的影响 |
验证化学能转化为电能 |
铁的析氢腐蚀实验 |
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。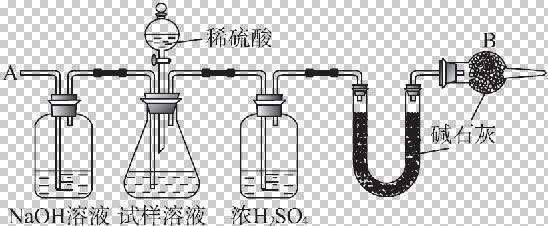
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性。
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液。
③称量盛有碱石灰的U形管的质量,得到b g。
④从分液漏斗滴入一定浓度的稀硫酸,直到不再产生气体时为止。
⑤从导管A处缓缓鼓入一定量的空气。
⑥再次称量盛有碱石灰的U形管的质量,得到c g。
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g。
请填空和完成问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明___________________。
(2)装置中干燥管B的作用是__________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_______________(填“偏高”“偏低”或“不变”)。
(4)步骤⑤的目的是__________________________________________。
(5)步骤⑦的目的是__________________________________________。
(6)该试样中纯碱的质量分数的计算式为___________________________。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
有二氧化碳参加或有二氧化碳生成的反应有下列几种情况:
(1)锥形瓶配有主导管的单孔塞,玻璃导管与大气相通,在瓶内玻璃管末端扎紧一个小气球如右图所示。锥形瓶内收集满二氧化碳,迅速投入下列物质,立即塞紧,振荡,一段时间后,气球会自动膨胀的是()
| A.Na2O | B.Na2O2 | C.NaHCO3 | D.NaOH |
(2)另取一个锥形瓶,配有双孔塞,一孔插入玻璃管,玻璃管与大气相通,瓶内玻璃管末端扎紧一个小气球;另一孔插入盛有浓氢氧化钠溶液的滴管,瓶内收集满二氧化碳,塞紧瓶塞。将此瓶放在托盘天平的左盘上,调节天平使之平衡。从天平上取下,挤压滴管使浓氢氧化钠溶液滴入瓶中,振荡,一段时间后再放回托盘天平的左盘上,天平指针________。(填“左偏”“右偏”或“不偏”,下同)
(3)再取一个锥形瓶,配有双孔塞,一孔插入玻璃管,玻璃管的瓶外一端扎紧一个小气球,另一孔插入盛浓盐酸的滴管,瓶内盛碳酸钙粉末和适量水。塞紧瓶塞,将此瓶放在托盘天平的左盘上,调节天平使之平衡。从天平上取下,挤压滴管使浓盐酸滴入瓶中,振荡,使两者反应完全后再放回托盘天平的左盘上,天平指针________。
由两种盐组成的白色粉末混合物,加热时无气体逸出。其焰色反应呈黄色,透过蓝色钴玻璃可观察到紫色。取此白色粉末加硝酸时,粉末完全溶解,生成的无色无味的气体可使澄清石灰水变浑浊。在上述粉末溶于过量的硝酸后的溶液中加入硝酸银溶液,有白色沉淀生成。试推断该混合物的可能组成,并简要说明理由。
某校化学兴趣小组的同学欲测定某种品牌纯碱中食盐的含量。
①称取某纯碱样品10.0 g放入烧杯中,并加适量蒸馏水使之完全溶解。
②____________________________________。
③____________________________________。
④用蒸馏水洗涤沉淀2—3次。
⑤将沉淀烘干、称量,测得固体质量2.87 g。
(1)补齐所缺少的实验步骤,将答案填写在上面②和③的空格处。
(2)实验步骤③所用的玻璃仪器有:____________________________________。
(3)在过滤器上洗涤沉淀的具体操作是:____________________________________。
(4)检验沉淀是否洗涤干净的方法是:____________________________________。
(5)若纯碱标签上标注:“Na2CO3含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?________(填“合格”或“不合格”)。