2005年诺贝尔化学奖授予法国和美国的三位科学家,以表彰他们在烯烃复分解反应研究方面作出的重要贡献。烯烃复分解反应过程被化学家描述为“交换舞伴的交谊舞”。
(I)下列图示可以被理解为烯烃复分解反应过程的是( )。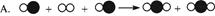

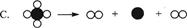

(II)烯烃复分解反应实现了在一定条件下烯烃中碳碳双键两边基团的换位。如:
又已知:两个醛分子在一定条件下可以发生加成反应: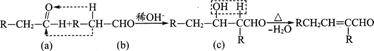
现仅以丙烯为有机原料,经过下列反应可以分别合成重要的化工原料F和K,以F和K为原料可合成一种链状高分子化合物M,其化学组成为(C12H20O4)n。
回答下列问题: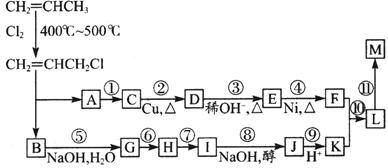
(1)反应①的反应类型是 ,反应⑤的反应类型是 。
(2)反应⑥⑦中有一反应是与HCl加成,该反应是 (填反应编号),
设计这一步反应的目的是 。
(3) 物质E的结构简式为: ,物质M的结构简式为: 。
(4)写出下列反应的化学方程式:反应⑧: ;
反应⑩: 。
(16分)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛 应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)该反应的化学方程式为,每生成1molNF3,转移的电子数为
生成物NF3中氮原子的杂化方式为,NF3分子空间构型为;
(2)N、F两种元素的氢化物稳定性比 较,NH3HF(选填“>”或“<”);
较,NH3HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式;
(4)氯化铜溶液中加入过量氨水,可以生成四氨合铜络离子,写出该反应的化学方程式;
(5)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如左图,该离子化合物的化学式为。
(6分,每空1分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
原子最外电子层上s电子数等于p电子数,等于电子层数。 |
(1)B元素在周期表中的位置是___区,写出A离子的电子排布式
(2)写出C单质与水反应的离子方程式 ________
(3)A、B、C、D四种元素的第一电离能由大到小的顺序________
(4)A、B两元素非金属性较强的是(写元素符号)________。写出证明这一结论的一个实验事实
(8分,除(4)题2分外,每空1分)元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式________;该分子中中心原子上的孤电子对数为,该分子VSEPR模型名称________,分子立体构型名称________
(2)写出X的质量分数为60%的化合物的σ键电子对数为_______,分子立体构型为_______
(3) 写出由宇宙中最丰富的元素Z、短周期中原子半径最大的主族元素W,与X、Y这四种元素组成的两种物质发生化学反应的方程式
(8分,每空1分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________________,该元素的符号是________
(2)Y元素原子的价层电子的轨道表示式为 ______________,
(3)X与Z可形成化合物XZ3,该分子的VSEPR模型名称__________该分子的立体构型名称_______
(4) Z原子的电子云是形,电子云图上的黑点稠密,表明单位体积内电子
(5)比较X的氢化物与同族第三周期元素所形成的氢化物稳定性并从键能角度说明理由
_____________________________________________________________
________________________________________________________________________
(9分,每空1分)元素A—D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
| 元素 |
A |
B |
C |
D |
| 性质或结构信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
+2价阳离子的核外电子排布与氖原子相同。 |
⑴上表中与A属于同一周期的元素是___(填元素符号),写出D离子的电子排
布式
⑵用电子式表示D和C形成的化合物的形成过程
写出C单质与水反应的化学方程式_____________________________________
⑶对元素B的单质或化合物描述正确的是_________ 。
a.B元素的最高正价为+6
b.常温、常压下单质难溶于水
c.单质分子中含有18个电子
⑷A在一定条件下发出黄光是A原子的电子从能量跃迁到能量
所释放的能量
(5)A和D量元素金属性较强的是(写元素符号)_______ 。写出能证明该结论的一个实验事实______________________________