(11分)某学生欲配制6.0 mol/L的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:
①480 mL 0.5 mol/L 的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________
_________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm 处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意
。
A~D是中学化学实验中常见的几种温度计装置示意图(图2-1-5)。
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C下的空格中(多选要倒扣分)。
①酒精和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯跟溴的取代反应
⑤石油分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度
⑧食盐和浓硫酸混合加热制氯化氢
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是:
测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g·cm-3)、水。按图2-1-2装置进行实验,回答下列问题(设合金样品全部反应,产生的气体不超过100mL)。
(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
(2)合金样品用铜网包裹的目的是:
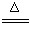
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为 
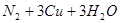
试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量(m(CuO)、m(H2O))时,请用下列仪器设计一个简单的试验方案。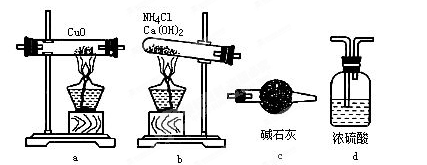
① 仪器连接的顺序(用字母编号表示,仪器可重复使用)_________;
d中浓硫酸的作用是________,______;
实验完毕时观察到a中的现象是__________;
② 列出计算Cu的相对原子质量的表达式_________;
③ 下列情况将使测定结果偏大的是________。(以下选择填空不限1个正确答案,均用字母编号填写)
A. CuO未全部还原为Cu
B. CuO受潮
C. CuO中混有Cu
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有_______
A. m(Cu)和m(CuO) B. m(N2)和m(H2O)
C. m(Cu)m(H2O) D. m(NH3)和m(H2O)
某学生设计了三个实验方案,用以检验淀粉的水解情况。
⑴方案甲:淀粉液 水解液
水解液 中和液
中和液 溶液变蓝
溶液变蓝
结论:淀粉没有水解
⑵方案乙:淀粉液 水解液
水解液 无红色沉淀
无红色沉淀
结论:淀粉没有水解
⑶方案甲:淀粉液 水解液
水解液 中和液
中和液 有红色沉淀
有红色沉淀
结论:淀粉已水解
以上三种方案的设计及结论是否正确?如不正确,请简述理由。
实验室里用一般的气体发生装置来制备Cl2,反应物即使在停止加热后反应还会继续一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如下图的甲装置来制取Cl2: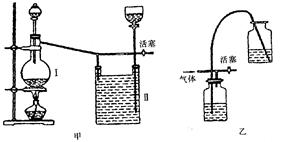
(1)设计甲装置是依据了(填已学某仪器名称)的原理。甲中装置
Ⅱ(填能或不能)用乙装置来代替。
(2)甲中Ⅱ中盛有的液体是,该装置可看作是一个(填某仪器名称),简述其主要原理: