氧化还原反应实际上包含氧化和还原两个过程:(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为SO2+2H2O-2e-=SO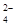 +4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为Cl2+2e-=2Cl-。已知在(1)和(2)中的反应均会生成产物X,则X的化学式为( )
+4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为Cl2+2e-=2Cl-。已知在(1)和(2)中的反应均会生成产物X,则X的化学式为( )
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
下列反应,不属于氧化还原反应的是
| A.Fe+CuSO4===FeSO4+Cu |
B.2HClO 2HCl+ O2↑ 2HCl+ O2↑ |
| C.2Na2O2+ 2CO2===2Na2CO3+ O2↑ |
| D.CaCO3+H2O+CO2="==" Ca(HCO3)2 |
下列各组微粒中,互为同位素的是
A.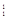 H2 和 H2 和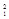 H2 H2 |
B.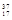 Cl和 Cl和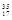 Cl Cl |
| C.O3和O2 | D. N 和 N 和 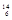 C C |
日本核电站泄漏物中含有放射性的53131I。有关53131I的说法不正确是
| A.中子数为78 | B.质子数为53 |
| C.质量数为131 | D.核外电子数是78 |
下列物质中属于电解质的是
| A.熔融的氯化镁 | B.金属铜 | C.二氧化碳 | D.酒精 |
下列溶液中Cl-浓度最大的是
| A.200mL 2mol/L MgCl2溶液 |
| B.1000mL 2.5mol/L NaCl溶液 |
| C.300mL 5mol/L KClO3溶液 |
| D.250mL 1mol/L AlCl3溶液 |