有一无色溶液,可能含有K+、Al3+、Mg2+、NH 、Cl- 、SO
、Cl- 、SO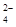 、HCO
、HCO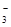 、Ba2+中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,只产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
、Ba2+中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,只产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A.肯定没有NH 、HCO 、HCO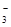 、Ba2+ 、Ba2+ |
B.可能有K+、Cl- 、HCO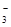 |
C.肯定有Al3+、Mg2+、SO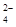 、NH 、NH |
| D.若另取部分原溶液,向其中加入足量AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- |
某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、I-等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中共含NO2-、CO32-、Cl-三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
| A.①②④⑤ | B.③④ | C.③④⑤ | D.②③⑤ |
用密度为ρ1g/cm3,质量分数是ω的浓盐酸,配制成体积比为1:4的稀盐酸,密度为
ρ2g/cm3,则所配制稀盐酸的物质的量浓度为
| A.mol/L | B. mol/L |
| C. mol/L | D. mol/L |
室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
| A.HCO3-、Al3+、Na+、SO42- | B.I-、NO3-、K+、NH4+ |
| C.MnO4-、Cl-、SO42-、K+ | D.SiO32-、SO32-、Na+、Cl- |
已知M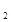 O
O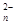 离子可与R
离子可与R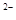 离子作用,R
离子作用,R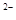 被氧化为R单质,M
被氧化为R单质,M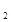 O
O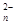 的还原产物中,M为+3价;又如c(M
的还原产物中,M为+3价;又如c(M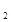 O
O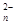 )="0.3" mol·L
)="0.3" mol·L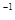 的溶液100 mL可与c(R
的溶液100 mL可与c(R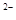 )="0.6" mol·L
)="0.6" mol·L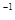 的溶液150 mL恰好完全反应,则n值为
的溶液150 mL恰好完全反应,则n值为
| A.4 | B.5 | C.6 | D.7 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M关于该反应的说法中正确的组合是
①氧化剂是H3AsO3;②还原性:Cl->As;③每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |