已知:SO32—+I2+H2O===SO42—+2H++2I-。某溶液中可能含有I-、NH4+、Cu2+、SO32—,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( )
| A.可能含Cu2+ | B.肯定不含NH4+ |
| C.一定含有SO32— | D.肯定不含I- |
两次获得诺贝尔奖,在化学界享有盛名的科学家是()
| A.爱因斯坦 | B.达尔文 | C.居里夫人 | D.欧拉 |
下列广告语在科学性上没有错误的是
| A.这种矿泉水绝对纯净,不含任何离子 |
| B.这种饮料中不含任何化学物质 |
| C.这种口服液含有丰富的氮、磷、锌等微量元素 |
| D.没有水就没有生命 |
观察下图,若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是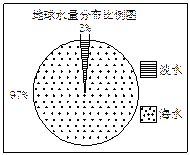
| A.100 mL烧杯 | B.50 mL烧杯 | C.100 mL量筒 | D.50 mL量筒 |
制备卤磷酸钙荧光粉所用的高纯氯化钙中混有氯化镁杂质,除去的方法是把氯化钙的水溶液加热到90~95℃,在不断搅拌下加入适当的沉淀剂,使镁生成沉淀过滤除去。此沉淀剂最好选用
| A.氢氧化钙乳浆 | B.碳酸钠溶液 | C.碳酸氢钠溶液 | D.氢氧化钠溶液 |
保护环境是每一个公民的责任。下列做法:① 推广使用无磷洗衣粉② 城市垃圾分类处理③ 推广使用一次性木质筷子④ 推广使用清洁能源⑤ 过量使用化肥、农药⑥ 推广使用无氟冰箱。其中有利于保护环境的是
| A.①②④⑤ | B.②③④⑥ | C.①②④⑥ | D.③④⑤⑥ |