若4g CO2中含有N个分子,则阿伏加德罗常数是( )
| A.11N/3 mol-1 | B.1/11N mol-1 | C.11Nmol-1 | D.3N/11 mol-1 |
下图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各组物质能利用这套装置进行实验的是
| A.MnO2和浓盐酸 | B.Na2SO3(s)和浓H2SO4 |
| C.Cu片和稀HNO3 | D.浓氨水和生石灰 |
1.92 g Cu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状 况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为
况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为
| A.504 mL | B.336 mL | C.224 mL | D.168 mL |
把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
| A.SO2 | B.Cl- | C.Fe3+ | D.NO |
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是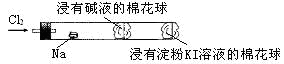
| A.钠着火燃烧产生苍白色火焰 |
| B.反应生成的大量白烟是氯化钠晶体 |
| C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 |
| D.管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |
下列有关实验的叙述中,正确的是
| A.红热的铁与水蒸气反应可生成氧化铁和氢气 |
| B.将二氧化硫通入到紫色石蕊试液中,试液先变红后褪色 |
| C.称量氢氧化钠固体时,应将氢氧化钠固体放在称量纸上称量 |
| D.加热时,可将试管、蒸发皿、坩埚直接在酒精灯焰上加热 |