NA代表阿伏加德罗常数,下列有关叙述正确的是
| A.1 mol羟基中含有10NA个电子 |
| B.标准状况下,22.4 L氢气和氧气的混合气体,含有NA个分子 |
| C.1 L 1 mol/L 的FeCl3溶液中含有NA个Fe3+ |
| D.1 mol Cu和足量稀硝酸反应生成NO 气体,转移3NA个电子 |
下列化学用语表达正确的是
| A.N = N为氮气的结构式 | B.SiO2为二氧化硅的分子式 |
C.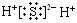 为H2S的电子式 为H2S的电子式 |
D. 为Na2O2的电子式 为Na2O2的电子式 |
下列每组中各物质内既有离子键又有共价键的一组是
| A.NaOH、H2SO4、 | B.MgO、Na2SO4 |
| C.KOH、(NH4)2SO4 | D.HCl、MgCl2 |
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重元素,该元素原子核内中子数与核外电子数之差是[
| A.57 | B.47 | C.61 | D.293 |
2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球——科学发展,构建和谐”。中国邮政并发行了纪念邮票。下列行为不符合活动主题的是:
| A.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| B.多走一天路,少开一天车 |
| C.更新采煤、采油技术,提高产量以满足工业生产的快速发展 |
| D.落实资源的“3R”发展观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
| 溶液组成主要成分 |
溶液中离子浓度关系 |
|
| A |
NaHCO3、Na2CO3 |
c(CO32-) < c(HCO3-) |
| B |
NaOH 、 Na2CO3 |
c(OH-)<c(CO32-) |
| C |
Na2CO3 |
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D |
NaHCO3、NaOH |
c(Na+) = c(HCO3-) |