(12分)现有下列9种物质:碳酸钠、氧化铁、二氧化硫、铜、氯气、氢氧化钾、硫酸、一氧化碳、硝酸铝,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:
属于酸性氧化物的有_____________,属于碱性氧化物的有_____________,
属于盐的有__________________________________。(用相应化学式填空)
(2)按要求完成下列方程式:
① 盐与酸反应_________________________________,
② 氧化物与碱反应_________________________________,
③ 属于氧化还原反应的化合反应_______________________________,
④ 不属于四种基本反应类型的氧化还原反应_______________________________。
若人体中缺少 以下各种元素之一,会出现各种症状,请找出之间对应的关系:缺乏维生素A ;缺乏维生素C ;缺钙;缺碘;缺氟;缺铁。
以下各种元素之一,会出现各种症状,请找出之间对应的关系:缺乏维生素A ;缺乏维生素C ;缺钙;缺碘;缺氟;缺铁。
症状:
| A.甲状腺肿大 | B.龋齿 | C.贫血 |
| D.夜盲症E.坏血病 F.佝偻病或骨质疏松 |
下边是温州城区2011年10月某日的空气质量日报
| 污染指数 |
首要污染物 |
空气污染指数 |
空气质量等级 |
||
| 二氧化硫 |
二氧化氮 |
可吸入颗粒物[ |
|||
| 55 |
78 |
56 |
良 |
(1)首要污染物是;
(2)空气污染指数是;
(3)能引起光化学烟雾的是(从表中选);
(4)能引起酸雨的是(从表中选)。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2 +、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下: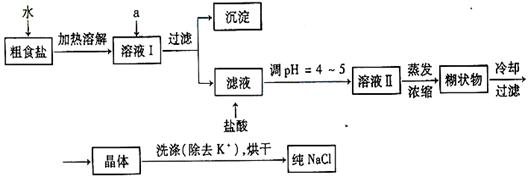 提供的试剂如下:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
提供的试剂如下:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的多种试剂,按滴加顺序依次为。(只填化学式)
(2)电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后(填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式。
(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4H Cl(浓)
Cl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置
(填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
(填代号)。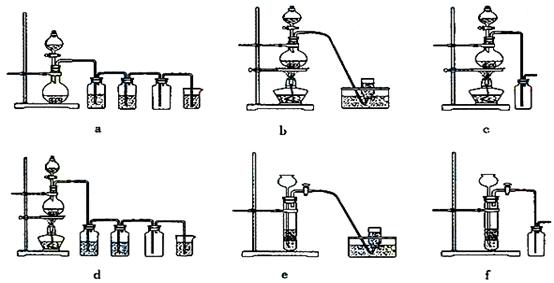
某澄清溶液,可能含有NH4+ 、Na+、K+、Cl-、CO32-、SO42-中的一种或几种,现做如下实验:
、Na+、K+、Cl-、CO32-、SO42-中的一种或几种,现做如下实验:
①取少量该溶液加入BaC l2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
l2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
②用铂丝蘸取少量该溶液置于无色酒精灯火焰中灼烧,火焰呈黄色,透过蓝色钴玻璃观察,未见紫色火焰。
③另取少量该溶液加入NaOH溶液并加热,将湿润的红色石蕊试纸靠近试管口无颜色变化。
(1)第①步可以检验出的离子是
(2)第②③步说明一定含有的离子是
(3)从以上操作中,不能判断是否存在的离子是 ,为了检验该离子是否存在,请你写出进一步检验的 操作步骤和实验现象:
操作步骤和实验现象:
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;
A原子核内仅有1个质子;B原子的电子总数与C原子的最外层电子数相等; C原子有两个电子层,最外层电子数是次外层电子数的3倍;D元素的最外层电子数是其电子层数的三分之一。E的单质是黄绿色气体且有毒。
(1)写出A分别与B、C所形成化合物的化学式:,。
(2)分别写出C和D的原子结构示意图:,。
(3)写出C、D、E所形成的化合物的电离方程式:。
(4)写出E的单质与A、C、D三元素所形成的化合物反应的化学方程式,若是氧化还原反应,请用双线桥标出电子转移的数目和方向:。