某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________________
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________。
【离子推断】某混合溶液中,只可能大量含有下表所列离子中的某几种:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
OH-、SO42-、CO32-、AlO2-、S2- |
将Na2O2逐渐加入到上述混合溶液中,产生沉淀的物质的量与加入Na2O2的物质的量的关系如图所示。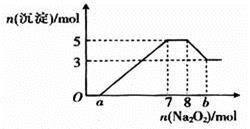
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加)。(每空1分)
| 离子种类 |
||||||
| 物质的量(mol) |
(2)图中a=____________, b=____________。
食用明胶是水溶性蛋白质混合物,具有很高的营养价值,溶于水形成胶体。而工业明胶中往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是___________价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成________。
(3)明胶的水溶液和K2SO4溶液共同具备的性质是___________。
a.都不稳定,密封放置沉淀
b.两者均会发生丁达尔效应
c.分散质微粒可通过滤纸
(4)已知胶体的分散质微粒不能透过半透膜,但小分子或离子能透过半透膜。现将10 mL明胶的水溶液与5 mL NaBr溶液混合后装入半透膜袋内,将此半透膜袋浸入盛蒸馏水的烧杯中。若要求只检验一种离子, 就能证明Na+、Br-透过半透膜,写出检验该离子的实验方法:______________________
(5)铬的化合价除了+3和+6价外,还有0,+2,+4和+5价等。现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为____________价。
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石的混合物。某化学兴趣小组从铁砂中分离出磁性氧化物,并进行铝热反应实验。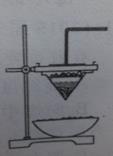
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是_________________现象很壮观,取少许生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现结果的原因,除了可能混有没有反应的磁性氧化铁外,还有一个原因是____________设计一个简单的实验方案,证明上述所得“铁块”中含有金属铝。该实验所用的试剂 是____________,反应的离子方程式_____________________
(2)写出此铝热反应的化学方程式:___________________________每摩尔单质铝参与反应,转移的电子数为___________________
(3)除磁性氧化铁可做铝热反应实验外,下列哪些试剂也可以()
| A.CuO | B.Na2O2 | C.MnO2 | D.MgO |
甲烷自热重整是先进的制氢方法, 包含甲烷氧化和蒸气重整。向反应系统同时通入甲烷、氧气和水蒸气, 发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)  CO2(g)+H2(g)的ΔH= kJ·mol-1。
CO2(g)+H2(g)的ΔH= kJ·mol-1。
(2)在初始阶段, 甲烷蒸气重整的反应速率 甲烷氧化的反应速率(填“大于”、“小于”或“等于”)。
(3)对于气相反应, 用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp), 则反应CH4(g)+H2O(g) CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)的Kp= 随着温度的升高, 该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析, 甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下, 温度、压强对H2和CO物质的量分数的影响如下图: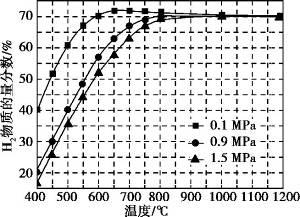
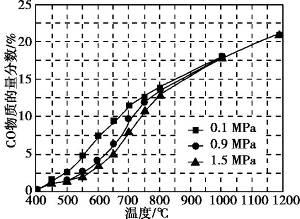
①若要达到H2物质的量分数>65%、CO物质的量分数<10%, 以下条件中最合适的是 。
A.600 ℃, 0.9 MPa B.700 ℃, 0.9 Mpa
C.800 ℃, 1.5 MPa D.1 000 ℃, 1.5 MPa
②画出600 ℃, 0.1 MPa条件下, 系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图: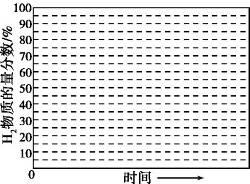
(6)如果进料中氧气量过大, 最终导致H2物质的量分数降低, 原因是 。
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为______________________。
(2)用CH4或其他有机物、O2为原料可设计成原电池,以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为___________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。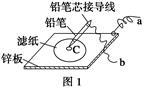

图2电池负极区的电极反应为_________________________;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现_____________色,C位置的电极反应式为___________________若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是__________(填A或B)电极。
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,试说明氯化铝的作用_______________________________(用必要的离子方程式和文字进行解释)。