A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如下表所示:
| 化合物 |
甲 |
乙 |
丙 |
丁 |
| 化学式 |
A2C |
A2C2 |
D2C2 |
D2E |
回答下列问题:
(1)用电子式表示形成化合物丁的过程 。
(2)写出丙与甲反应的化学方程式:
(3)固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过,该电池的工作原理如下图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。①O2-流向 极(填“正极”或“负极”)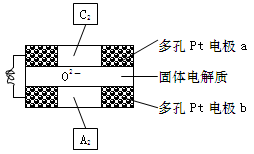
②该电池的正极反应为 ,负极反应为 。
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)  2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示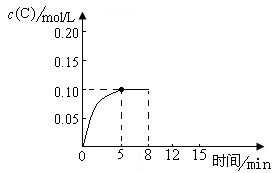
(1)已知该反应只有高温下能自发进行,则该反应的△H0(填“>”、“<”或“=”)。
(2)在上述反应条件下,从反应开始到平衡,用V(B)=mol·L-1·min-1,500℃时的平衡常数K=;
(3)在反应温度和容器体积不变的条件下,下列能说明上述反应达到平衡状态的是;
A.混合气体的压强保持不变
B.气体C的体积分数保持不变
C.混合气体的密度保持不变
D.B的正反应速率等于C的逆反应速率
(4)在500℃时,上述反应达到平衡后,在8min时将容器体积迅速压缩为1.0L,反应在12min建立新的平衡,画出8~15min内C气体物质的量浓度随时间变化的示意图。
运用甲烷自热来制取氢气是目前较为先进的技术。其涉及的反应如下:
①CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1=+165.0 kJ/mol反应活化能Ea1="243.9" kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-802.6 kJ/mol反应活化能Ea2="125.6" kJ/mol
(1)2H2(g) + O2(g)= 2H2O(g)△H3= kJ/mol;
(2)下面能正确表示氢气和氧气反应生成水的能量变化示意图的是(填字母序号)。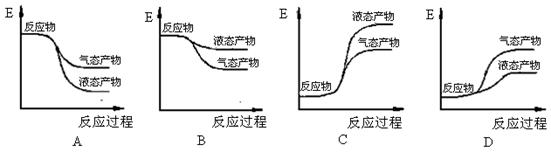
(3)运用甲烷自热来制取氢气是目前较为先进的技术。在同一反应系统同时通入甲烷、氧气和水蒸气,发生如上反应①和反应②,则反应开始时,反应①的反应速率反应②的反应速率(填“>”、“<”或“=”),理由是;从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是;
已知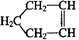 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: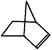
(1)降冰片烯属于。
A.环烃B.不饱和烃C.烷烃D.芳香烃
(2)降冰片烯的分子式为。
(3)降冰片烯与溴水反应的化学方程式为。
(4)降冰片烯不具有的性质
A.能溶于水B.能发生氧化反应
C.能发生加成反应D.常温常压下为气体
(5)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为。
(6分)在某温度下,取一定质量的CuSO4溶液,用石墨做电极进行电解,当阳极产生标准状况下气体1.12 L时,CuSO4恰好被完全电解,得到密度为1.2 g/cm3的溶液200 mL。求:
(1)电解后,所得溶液的pH=。
(2)电解前,所取CuSO4溶液的质量为。
(3)若要使电解后所得溶液恢复至电解前的原始状态,需要加入质量为。
(6分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa;⑤NaOH,已知:CO2+3H2O+2AlO2-= 2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是:(填编号);
(2)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是:(填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式:。