已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是
(提示:KspAgCl>KspAgI)
| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 被恰好完全沉淀 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
某同学按下图所示的装置进行试验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处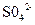 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
A.B的电极反应:
B.在ASO4溶液中,(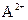 )浓度减小
)浓度减小
C. 电极上有
电极上有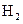 产生,发生还原反
产生,发生还原反
应
D.反应初期, 电极周围出现白色胶状沉淀
电极周围出现白色胶状沉淀
.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是: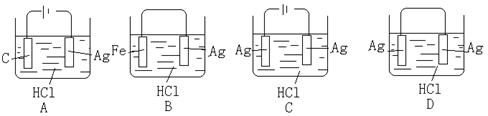
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的液中加
0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子为
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)
为多孔石墨电极。接通S后,C (Ⅱ)附近溶液变红,两玻璃管中有气体生成。下列说法正确的是
| A.C(Ⅱ)的电极名称是阳极 |
| B.电子从电源的负极沿导线流向C(Ⅱ) |
| C.C(Ⅰ)的电极反应式是2H+ + 2e-+ =H2 ↑ |
| D.电解过程中,C(Ⅰ)、C(Ⅱ)两极产生的气体质量相等 |

镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是 Cd+2OH-—2e-===Cd(OH)2,
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH- 下列说法不正确的是
下列说法不正确的是
| A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2 |
| B.电池充电时,镉元素被还原 |
| C.电池放电时,电池负极周围溶液的pH不断增大 |
| D.电池充电时,电池的负极和电源的负极连接 |