银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn(OH)2  Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是
Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是
| A.Ag | B.Zn | C.Ag2O | D.Zn(OH)2 |
在一定条件下,RO3-与R-发生反应:RO3-+5R-+6H+=3R2+3H2O。Q元素与R元素同族,且均为短周期元素。下列说法正确的是
| A.R.Q是VA族元素 |
| B.R的氢化物稳定性大于Q的氢化物的稳定性 |
| C.氧化产物和还原产物的质量比之为1:5 |
| D.R的最高价氧化物的水化物的酸性强于H2SO4 |
某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖。他的操作如下:取少量纯蔗糖加水配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;在冷却后的溶液中加入银氨,在水浴中加热。实验结果没有银镜产生。其原因是
| A.蔗糖尚未水解 | B.煮沸后的溶液中没有加碱,以中和作催化剂的酸 |
| C.加热时间不够 | D.蔗糖水解的产物中没有葡萄糖 |
某有机物的结构为下图所示,这种有机物不可能具有的性质是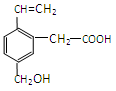
①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应
| A.①④ | B.只有⑥ | C.只有⑤ | D.④⑥[ |
下列说法正确的是
| A.化学反应中的能量变化都表现为热量的变化 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.放热反应在常温下一定很容易发生 |
| D.反应是吸热还是放热必须看反应物和生成物的总能量的大小 |
关于离子键、共价键的各种叙述中,下列说法中正确的是
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
| D.由不同元素组成的含多个原子的分子里,一定只存在极性键 |