下列叙述中,正确的是( )
| A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g) + 2O2(g) ="==" CO2(g) + 2H2O(g) ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为: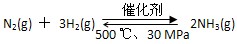 ΔH=-38.6 kJ·mol-1 ΔH=-38.6 kJ·mol-1 |
| C.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| D.常温下,反应C(s) + CO2(g) ="==" 2CO(g)不能自发进行,则该反应的ΔH>0 |
漆酚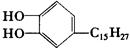 是生漆的主要成分,黄色,能溶于有机溶剂中。生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,它不具有的化学性质为( )
是生漆的主要成分,黄色,能溶于有机溶剂中。生漆涂在物体表面,能在空气中干燥转变为黑色漆膜,它不具有的化学性质为( )
| A.可以燃烧,当氧气充分时,产物为CO2和H2O |
| B.与FeCl3溶液发生显色反应 |
| C.能发生取代反应和加成反应 |
| D.不能被酸性KMnO4溶液氧化 |
下列物质久置于空气中,颜色发生变化的是 ( )
A.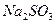 |
B.苯酚 | C.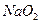 |
D.CaO |
摄影胶卷上涂布的感光材料主要是AgBr。在照相时按动快门一瞬间,进入相机的光使AgBr发生了分解反应2AgBr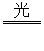 2Ag+Br2。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
2Ag+Br2。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化: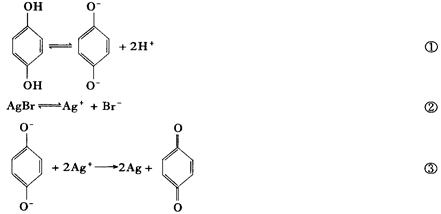
(1)曝光时所产生的微量Ag在显影过程中_________。
(A)是氧化剂(B)是还原剂
(C)起催化剂的作用 (D)不起什么作用
(2)显影液中如果只溶有对苯二酚,显影速度则非常缓慢。为提高显影速度,可加入_________。
(A)Na2SO4 (B)Na2SO3(C)Na2CO3 (D)Na2S2O3
(3)溶于显影液中的氧气能与对苯二酚反应,最终生成棕褐色的污斑,影响底片的质量。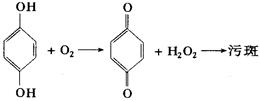
为避免形成污斑,可向显影液中加入_________。
(A)Na2SO4 (B)Na2SO3(C)Na2CO3 (D)Na2S2O3
奥运会会标是五环旗,假定奥运五环旗中的每一环
表示一种物质,相连环物质间一定条件下能发生常见反应,
不相连环物质间不能发生反应。且四种反应中必须包含化合
反应、置换反应及复分解反应,适合的一组是
| 选项 |
蓝 |
黑 |
红 |
黄 |
绿 |
| A |
SiO2 |
CuSO4溶液 |
O2 |
NaOH溶液 |
Ag |
| B |
O2 |
稀H2SO4 |
CO2 |
Fe |
NaOH溶液 |
| C |
O2 |
稀H2SO4 |
Al(OH)3 |
NH3 |
NaOH |
| D |
Mg |
CO2 |
KOH溶液 |
Al |
Fe2O3 |
|
可再生能源是我国重要的能源资源,在满足能源需求、改善能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能碱排的一项重要措施。下列有关分析不正确的是
A,风电、太阳能、生物质能等属于可再生能源