按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5 g (不考虑水的蒸发)。 则下列叙述中正确的是( )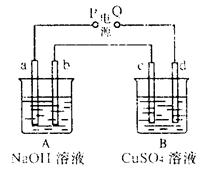
A.电源P极为正极
B.标准状况下,b极产生气体的体积为5.6 L
C.c极上析出固体的质量为16 g
D.a极上所发生的电极反应式为40H--4e-= 2H2O+O2↑
某原电池总反应的离子方程式是:Zn+Cu2+====Zn2++Cu,则此反应的原电池的正确组成是( )
正极负极电解质溶液
| A.Cu Zn HCl | B.Zn Cu CuSO4 |
| C.Cu Zn CuSO4 | D.Cu Zn ZnCl2 |
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易被腐蚀。将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.A>B>C>D B.D>A>B>C
C.C>A>B>D D.B>C>A>D
在铜制品上的铝制铆钉,在潮湿空气中容易腐蚀的原因可说明( )
| A.形成原电池,铝作负极 | B.形成原电池,铜作负极 |
| C.形成原电池时,电流经导线流向铜 | D.铝铆钉发生了电化学腐蚀 |
对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是( )
| A.以石墨为电极,电解含甲基橙的0.1 mol·L-1硫酸溶液 |
| B.以铜为电极,电解1 mol·L-1硫酸溶液 |
| C.以石墨为电极,电解含酚酞的饱和食盐水 |
| D.以石墨为电极,电解1 mol·L-1溴化钾溶液 |
氢氧燃料电池所耗原料为H2和O2,电极为多孔镍,电解质溶液为30%的KOH溶液。下列有关叙述正确的是( )
| A.负极反应为O2+4e-+2H2O====4OH- |
| B.正极反应为2H2+4OH--4e-====4H2O |
| C.工作时正极区pH升高,负极区pH降低 |
| D.工作时,溶液中阴离子移向正极 |