已知:①MnO4— +e- MnO42―(绿色)(强碱性条件)
MnO42―(绿色)(强碱性条件)
②MnO4—+ 8H+ + 5e- Mn2+(无色)+ 4H2O(强酸性条件)
Mn2+(无色)+ 4H2O(强酸性条件)
(1)在KOH溶液中,KMnO4与K2SO3溶液发生反应, 写出反应的离子方程式 。
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式 .
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,MnO4‑具有氧化性,最合适的亚铁盐是 (选填编号),可用来酸化KMnO4溶液的试剂是 (选填编号)
a. FeCl2 b. FeSO4 c.Fe(NO3)2 d稀硫酸 e. 盐酸 f. 硝酸
(4)向20 mL浓度为0.05mol/L的KMnO4溶液中滴加FeSO4溶液,使MnO4‑全部转化为Mn2+ ,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于 mL
(1)同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为_______。
(2)8.4g N2与9.6g某单质Rx,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是,x值为。
下列两个反应均为在溶液中进行的反应,试按下列要求作答:
①在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物。
②将其改写成离子方程式;
(1) 2FeCl3 + H2S =2FeCl2 + S↓ + 2HCl
| 氧化剂: |
还原剂: |
||
| 氧化产物: |
还原产物: |
离子方程式为:____________________________________。
(2)MnO2 + 4HCl(浓) 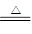 MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
| 氧化剂: |
还原剂: |
||
| 氧化产物: |
还原产物: |
离子方程式为:___________________________________。
从①Ba(OH)2 ②HCl ③Zn ④CuSO4 ⑤CaCO3中选出合适的物质,实现下列各题要求的变化,写出化学反应的化学方程式,是离子反应的写出离子方程式。
(1)实验室制取CO2的反应
(2)实验室制取H2的反应
(3)生成沉淀的反应
(4)盐与金属的置换反应
(5)酸碱之间的中和反应
现有以下物质:①NaCl晶体, ②液态HCl, ③ CaCO3固体, ④熔融KCl, ⑤蔗糖, ⑥铜, ⑦CO2,⑧浓H2SO4,⑨KOH固体。以上物质中属于电解质的是,属于非电解质的是,在该状态下能导电的是。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径 |
0.102 |
0.075 |
0.117 |
0.074 |
0.110 |
0.071 |
0.099 |
0.077 |
| 最高化合价 |
+6 |
+5 |
+4 |
+5 |
+7 |
+4 |
||
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,②B与D可形成多种化合物,其中BD、BD2是常见的化合物,C可用于制光电池。请回答:
(1)E在周期表中位置是:
(2)C和H的气态氢化物的稳定性强弱关系为:(用分子式表示)
(3)32g AD2气体和D2气体恰好完全反应生成AD3气体,放出49.15kJ的热量,则其反应热化学方程式为:
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:。
(5)工业上可用纯碱溶液处理BD和BD2,该反应如下:
BD+BD2+Na2CO3=2 +CO2横线上某盐的化学式应为