(1)完成并配平白磷和氯酸溶液反应的化学方程式:
P4 + HClO3 + → HCl + H3PO4
(2)白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是 ,若有1.1 mol P4反应,则有 mol电子转移;
(3)磷的一种化合物叫亚磷酸(H3PO3)。
已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;
⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO3的说法:①强酸;②弱酸;
③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是 。
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |
有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
已知:①RCH=CH2+CO+H2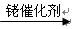

②烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物c的核磁共振氢谱显示其分子中含有5种氢原子,且其峰面积之比为3:2:2:2:1;DBP分子中苯环上的一溴取代物只有两种。
(1)A的结构简式是 。
。
(2)B含有的官能团名称是 。
(3)有机物C和D反应生成DBP的化学方程式是 。
(4)下列说法正确的是(选填序号字母) 。
a.A能发生聚合反应、加成反应和氧化反应
b.和C互为同分异构体,且含有相同官能团的有机物有2种
c.邻二甲苯能氧化生成D说明有机物分子中基团之间存在相互影响
d.1 mol DBP可与含2 mol NaOH的溶液完全反应
(5)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
①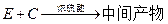 ②
②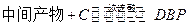
工业生产中在第②步中使用油水分离器将反应过程中生成的水不断从反应体系中分离除去,其目的是 。
(6)工业上生产有机物E的反应如下: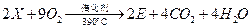
芳香烃X的一溴取代物只有两种,X的的结构简式是 。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是 和 (填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质为记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴人稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:X为 。
A.SO3- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液中所有离子的浓度由大到小的顺序为 (用离子符号表示)。
(4)将0.02 mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (保留一位小数)。
(5)将Cu投人到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离子方程式为: 。
(6)利用上述已经确定的物质,可以检验出D,E中的阳离子。请简述实验操作步骤、现象及结论 。
如右图所示,A为电源,B为浸透饱和食盐水和酚酞试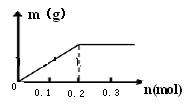
液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解
槽,其电极材料及电解质溶液见图。
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴
向c端移动,则电源b端为极,通电一段时间后,
观察到滤纸d端的电极反应式是:;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。
则Cu2+、X3+、H+氧化能力由大到小的顺序是;
D装置中溶液是H2SO4,则电极Pt端的实验现象是:
_____________________。
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题: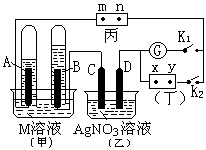
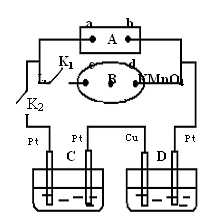
(1)M溶液可能是(填序号)。
A.KNO3溶液B. Ba(OH)2溶液 C.H2SO4溶液
D. NaCl溶液 E.CuSO4溶液
(2)X为电源极,m点的现象。
(3)C极的电极反应式为。
(4)若乙池中AgNO3溶液电解后体积为100mL,测得溶液的pH=1, 则乙池中C极析出的固体质量为g。
(5)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为。
如下图所示,A、E为石墨电极,B、F为铁片电极。按要求回答下列问题。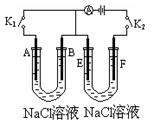
(1)打开K2,合并K1。B为极,A的电极反应为,最终可观察到的现象是,
涉及的化学反应方程式有:
。
(2)打开K1,合并K2。
F为极,F极的电极反应为,
电解过程中,观察到溶液的现象是。