下列说法正确的是
| A.苯能使酸性KMnO4溶液褪色 | B.汽油、柴油和植物油都是碳氢化合物 |
| C.乙酸和油脂都能与氢氧化钠溶液反应 | D.苯在工业上主要是通过石油分馏得到 |
(9分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为;化合物BA4的电子式为.
(2)化合物Y2X2中含有的化学键类型有________(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物Y2X2和A2X反应的化学方程式
(4)请用电子式表示Y2Z的形成过程_________________________.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。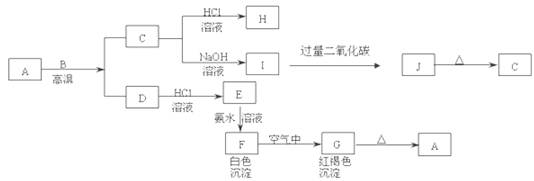
(1)写出下列物质的化学式:
A:E:J:G:
(2)按要求写方程式:
F在空气中转化为G的化学方程式:;
C转化为I的离子方程式:;
I转化为J的离子方程式:。
已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)写出A的结构简式。
(2)B、C分子中的官能团名称分别是、。
(3)写出与E具有相同官能团的D的同分异构体的结构简式。
(4)写出下列反应的化学方程式:
①;反应类型:。
④;反应类型:。
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上(填“有”或“没有”)气泡产生。
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。图乙、图丙是一个将能转化为能的装置,人们把它叫做原电池。
(3)从上述现象中可以归纳出构成原电池的一些条件是;
有关的电极反应式:
锌片;铜片。
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,这段反应速率最快的原因是。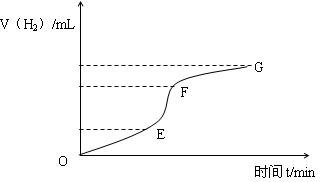
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是()
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(回答一种即可)
。