巨豆三烯酮(F)是一种重要的香料,其合成路线如下: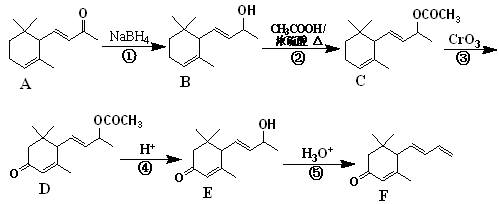
(1)化合物F的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2。
(2)在上述转化过程中,反应②的目的是 ,写出反应②的化学方程式为 。
(3)下列说法正确的是 (双选,填字母)。
A.化合物A ~ F均属于芳香烃衍生物
B.反应①属于还原反应
C.1 mol 化合物D可以跟4 mol H2发生反应
D.化合物F含有的官能团名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式为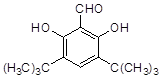 ,请写出另外一种同分异构体的结构简式 。
,请写出另外一种同分异构体的结构简式 。
A.属于芳香族化合物;
B.核磁共振氢谱显示,分子中有4种化学环境不同的氢原子;
C.1mol该物质最多可消耗2molNaOH
D.能发生银镜反应。
( 6分) A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。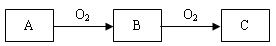
(1)若A是一种黄色单质固体,则A的分子式为。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为,试用化学方程式表示该物质的一个重要应用。
(3)若C是红棕色气体,则A的化学式可能为。
A、B两种酸式含氧酸盐的相对分子量均为120,且都溶于水;D气体能使品红溶液褪色;F固体为淡黄色;E是不溶于水和盐酸的白色沉淀,它们之间的转化关系如图所示: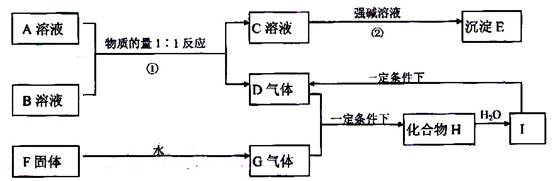
(1)写出化学式:F____________;G___________;D___________;H___________。
(2)写出反应②的离子方程式:
②:_______________________________________________________。
(3)写出一个由I生成D的化学方程式:_______________________________。
在新疆和青海交界处有一狭长山谷。有时风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭雷击到下。奇怪的是这里的牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。请用化学方程式表示“魔鬼谷”牧草茂盛,四季常青的原因、
、
(3分) 原子序数小于20的A、B、C、D四种元素,最高正价依次为1、4、5、7,核电荷数按B、C、D、A顺序递增,已知B原子次外层为2个电子,C、D、A原子次外层为8个电子,则这四种元素的原子的质子数之和为。
(6分) 某溶液中含有SO42-、CO32-、OH-三种阴离子,如果只取一次溶液,分别将这三种离子检验出来,那么应:
⑴先检验,加入试剂(或溶液)
⑵再检验,加入试剂(或溶液)
⑶最后检验,加入试剂 (或溶液)